Recapitulación 14
Equipo 1
El día martes 9 de noviemre revisamos el tema de las propiedades periódicas y un profesor nos vino a mostrar cual es la reacción del nitrogeno líquido con algunos objetos y observamos que debido a su baja temperatura, congeló dichos objetos y al momento de ponerlos a temperatura ambiente, después de un rato, regresaron a su estado natural.
El día jueves 11 de noviembre vimos la estructura de Lewis de cada familia de la tabla periódica y sus enlaces químicos, después realizamos una práctica en la cual observamos la conductividad electrica y eltipo de enlace que tienen algunas sustancias.
Blog para la materia de Química II en el CCH Sur!!
Equipoo 1! Grupo 206 Sección B
Profe: Manuel Agustín García López
^^
>>González Diego Laura Rigel<< ☻
Equipoo 1! Grupo 206 Sección B
Profe: Manuel Agustín García López
^^
>>González Diego Laura Rigel<< ☻
lunes, 22 de noviembre de 2010
miércoles, 17 de noviembre de 2010
Representación de los Electrones de Valencia
¿Que son y cómo se representan los electrones de valencia?
Los electrones de valencia son los electrones que se encuentran ubicados en la última capa o nivel energético de determinado átomo. Se llaman así porque estos determinan la valencia o número de oxidación de determinado elemento.
Y se representan por la estructura de Lewis:

Escribir la estructura de Lewis de cada Familia.

• En química, el enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
• Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
• En un enlace metálico, los electrones de enlace están des localizados en una estructura de átomos. En contraste, en los compuestos iónicos, la ubicación de los electrones enlazantes y sus cargas es estática. Debido a la deslocalización o el libre movimiento de los electrones, se tienen las propiedades metálicas de conductividad, ductilidad y dureza.
Determinación del tipo de enlace químico.
Material: Probador de conductividad eléctrica, capsula de porcelana.
Sustancias: Cloruro de sodio, sacarosa, metales, agua, alcohol.
Procedimiento:
a.- Colocar en la capsula de porcelana una muestra del cloruro de sodio, probar su conductividad eléctrica en seco, agregar unas gotas de agua y probar nuevamente su conductividad eléctrica. Anotar las observaciones.
b.- Repetir el paso a con las demás sustancias.
c.- Observaciones:

Conclusiones:
Con los experimentos realizados vimos los diferentes tipos de enlaces que hay como son el iónico al prestar uno de sus electrones para formar la capa de valencia, el covalente compartir los electrones y el metálico es la nube electrónica que permite el paso de la corriente eléctrica.


Los electrones de valencia son los electrones que se encuentran ubicados en la última capa o nivel energético de determinado átomo. Se llaman así porque estos determinan la valencia o número de oxidación de determinado elemento.
Y se representan por la estructura de Lewis:

Escribir la estructura de Lewis de cada Familia.

• En química, el enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
• Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
• En un enlace metálico, los electrones de enlace están des localizados en una estructura de átomos. En contraste, en los compuestos iónicos, la ubicación de los electrones enlazantes y sus cargas es estática. Debido a la deslocalización o el libre movimiento de los electrones, se tienen las propiedades metálicas de conductividad, ductilidad y dureza.
Determinación del tipo de enlace químico.
Material: Probador de conductividad eléctrica, capsula de porcelana.
Sustancias: Cloruro de sodio, sacarosa, metales, agua, alcohol.
Procedimiento:
a.- Colocar en la capsula de porcelana una muestra del cloruro de sodio, probar su conductividad eléctrica en seco, agregar unas gotas de agua y probar nuevamente su conductividad eléctrica. Anotar las observaciones.
b.- Repetir el paso a con las demás sustancias.
c.- Observaciones:

Conclusiones:
Con los experimentos realizados vimos los diferentes tipos de enlaces que hay como son el iónico al prestar uno de sus electrones para formar la capa de valencia, el covalente compartir los electrones y el metálico es la nube electrónica que permite el paso de la corriente eléctrica.


Propiedades Periódicas de los Elementos
Indagación Bibliográfica 08-12 Nov
UNIDAD 2
SEXTA SEMANA
Propiedades Periódicas
Una de las ventajas de la Tabla Periódica es que permite predecir las propiedades de los elementos con sólo ver su posición dentro de ella. Además se debe mencionar que la tabla periódica permite realizar comparaciones entre diferentes propiedades de los elementos. Estas propiedades se conocen como PROPIEDADES PERIÓDICAS. Las principales propiedades periódicas son: volumen atómico, potencial de ionización, afinidad electrónica y electronegatividad.
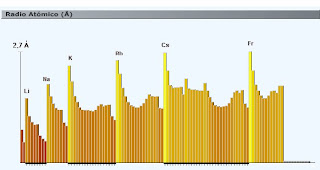
# Radio Atómico.
El Radio atómico que es una medida del tamaño atómico decrece a lo largo de un período y aumenta al ir bajando de período (Niveles superiores). La explicación de ésto es que el núcleo va aumentando de carga para un mismo período por lo que los electrones son más fuertemente atraídos hacia el núcleo. El radio atómico aumenta al añadir un nuevo nivel de energía.
La distancia de los electrones más externos al núcleo. Esta distancia se mide
en Angström (A=10-8), dentro de un grupo Sistema periódico, a medida que aumenta el número atómico de los miembros de una familia aumenta la densidad, ya que la masa atómica crece mas que el volumen atómico, el color F (gas amarillo verdoso), Cl (gas verde),
Br (líquido rojo), I sólido (negro púrpura), el lumen y el radio atómico, el carácter metálico, el radio iónico, aunque el radio iónico de los elementos metálicos es menor que su radio atómico.
# Energía de Ionización
Se conoce como primera energía de ionización a la energía necesaria para separar el electrón más externo de un átomo neutro en estado gaseoso sin proporcionarle energía cinética.
Según esta definición, E.I. dependerá de tres factores: la distancia del electrón al núcleo, la carga nuclear y el efecto pantalla.
Emplea el método de Slater para calcular las afinidades electrónicas de los elementos del segundo período y compara sus resultados con los experimentales de la tabla 9.5 del Cruz,Chamizo & Garritz (Mr. Profe & Jefe). ¿Qué puedes comentar al respecto?
La variación de la energía de ionización se explica a continuación:
Dentro de un mismo grupo la E.I. disminuye de arriba a abajo. Esto se debe a que conforme descendemos en la tabla periódica los átomos tienen más electrones, lo cual disminuye la atracción sobre el electrón más externo (efecto pantalla).
En un mismo periodo la E.I. aumenta de izquierda a derecha. Este comportamiento se explica debido a que conforme avanzamos de izquierda a derecha, el electrón externo del átomo está menos alejado del núcleo y por tanto la fuerza con la cual es atrído aumenta. (distancia al núcleo, radio atómico).
Una regla empírica que relaciona en forma aproximada los valores de
altas energías de ionización sucesivas de electrones que ocupan la misma capa atómica es In = (n+1)/n * I(n-1) Utilizando el dato experimental de I3, estima con ella el valor de I4 para estaño, antimonio, telurio y yodo, y discute su validez.
# Electro-Afinidad
Energía desprendida por un ion gaseoso que recibe un electrón y pasa a átomos gaseosos, es igual el valor al potencial de ionización y disminuye al aumentar el número atómico de los miembros de una familia. La electronegatividad es la tendencia de un átomo a captar electrones. En una familia disminuye con el número
atómico y en un período aumenta con el número atómico.
Otra definición sería que el cambio de Energía Asociado con el proceso con el cual un electrón se agrega a un átomo gaseoso en estado fundamental.
Electronegatividad: Medida de la capacidad relativa de un átomo en una molécula para atraer electrones hacia él mismo.
# Electro Negatividad
La electronegatividad es la capacidad que tienen los elementos de atraer hacia sí los electrones de enlace.
La electronegatividad varía de la siguiente forma:
Para un mismo grupo la electronegatividad disminuye de arriba hacia abajo.
En un mismo periodo la electronegatividad aumenta de izquierda a derecha.
SEXTA SEMANA
Propiedades Periódicas
Una de las ventajas de la Tabla Periódica es que permite predecir las propiedades de los elementos con sólo ver su posición dentro de ella. Además se debe mencionar que la tabla periódica permite realizar comparaciones entre diferentes propiedades de los elementos. Estas propiedades se conocen como PROPIEDADES PERIÓDICAS. Las principales propiedades periódicas son: volumen atómico, potencial de ionización, afinidad electrónica y electronegatividad.
# Radio Atómico.
El Radio atómico que es una medida del tamaño atómico decrece a lo largo de un período y aumenta al ir bajando de período (Niveles superiores). La explicación de ésto es que el núcleo va aumentando de carga para un mismo período por lo que los electrones son más fuertemente atraídos hacia el núcleo. El radio atómico aumenta al añadir un nuevo nivel de energía.
La distancia de los electrones más externos al núcleo. Esta distancia se mide
en Angström (A=10-8), dentro de un grupo Sistema periódico, a medida que aumenta el número atómico de los miembros de una familia aumenta la densidad, ya que la masa atómica crece mas que el volumen atómico, el color F (gas amarillo verdoso), Cl (gas verde),
Br (líquido rojo), I sólido (negro púrpura), el lumen y el radio atómico, el carácter metálico, el radio iónico, aunque el radio iónico de los elementos metálicos es menor que su radio atómico.
# Energía de Ionización
Se conoce como primera energía de ionización a la energía necesaria para separar el electrón más externo de un átomo neutro en estado gaseoso sin proporcionarle energía cinética.
Según esta definición, E.I. dependerá de tres factores: la distancia del electrón al núcleo, la carga nuclear y el efecto pantalla.
Emplea el método de Slater para calcular las afinidades electrónicas de los elementos del segundo período y compara sus resultados con los experimentales de la tabla 9.5 del Cruz,Chamizo & Garritz (Mr. Profe & Jefe). ¿Qué puedes comentar al respecto?
La variación de la energía de ionización se explica a continuación:
Dentro de un mismo grupo la E.I. disminuye de arriba a abajo. Esto se debe a que conforme descendemos en la tabla periódica los átomos tienen más electrones, lo cual disminuye la atracción sobre el electrón más externo (efecto pantalla).
En un mismo periodo la E.I. aumenta de izquierda a derecha. Este comportamiento se explica debido a que conforme avanzamos de izquierda a derecha, el electrón externo del átomo está menos alejado del núcleo y por tanto la fuerza con la cual es atrído aumenta. (distancia al núcleo, radio atómico).
Una regla empírica que relaciona en forma aproximada los valores de
altas energías de ionización sucesivas de electrones que ocupan la misma capa atómica es In = (n+1)/n * I(n-1) Utilizando el dato experimental de I3, estima con ella el valor de I4 para estaño, antimonio, telurio y yodo, y discute su validez.
# Electro-Afinidad
Energía desprendida por un ion gaseoso que recibe un electrón y pasa a átomos gaseosos, es igual el valor al potencial de ionización y disminuye al aumentar el número atómico de los miembros de una familia. La electronegatividad es la tendencia de un átomo a captar electrones. En una familia disminuye con el número
atómico y en un período aumenta con el número atómico.
Otra definición sería que el cambio de Energía Asociado con el proceso con el cual un electrón se agrega a un átomo gaseoso en estado fundamental.
Electronegatividad: Medida de la capacidad relativa de un átomo en una molécula para atraer electrones hacia él mismo.
# Electro Negatividad
La electronegatividad es la capacidad que tienen los elementos de atraer hacia sí los electrones de enlace.
La electronegatividad varía de la siguiente forma:
Para un mismo grupo la electronegatividad disminuye de arriba hacia abajo.
En un mismo periodo la electronegatividad aumenta de izquierda a derecha.
lunes, 15 de noviembre de 2010
Recapitulación Viernes 5/Nov
Recapitulación
Equipo 1
El día martes 2 de noviembre no asistimos a clases.
El día jueves 4 de noviembre revisamos varios temas como el de las propiedades físicas de los metales y no metales, la estructura atómica de los metales principales, también vimos dos videos relacionados con los temas anteriores y por último el profesor nos mostró que pasa cuando se aplica energía a los no metales.
Equipo 1
El día martes 2 de noviembre no asistimos a clases.
El día jueves 4 de noviembre revisamos varios temas como el de las propiedades físicas de los metales y no metales, la estructura atómica de los metales principales, también vimos dos videos relacionados con los temas anteriores y por último el profesor nos mostró que pasa cuando se aplica energía a los no metales.
domingo, 7 de noviembre de 2010
¿Cuáles son las Propiedades Físicas de los metales y no-metales.?
Indagación Bibliográfica 01-05 Nov
UNIDAD 2
QUINTA SEMANA
Propiedades Físicas
Las propiedades físicas son aquellas en las que se mantienen las propiedades originales de la sustancia ya que sus moléculas no se modifican.
Propiedades específicas de los sólidos
* Adherencia: atracción o unión entre las moléculas próximas de los cuerpos.
* Aleabilidad: propiedad que tienen los materiales para formar aleaciones que dan lugar a nuevos materiales mejorando sus prestaciones. En todas las aleaciones un componente como mínimo tiene que ser un metal.
* Calor específico. La capacidad calorífica o calor específico de una sustancia es la cantidad de energía necesaria para aumentar 1 ºC su temperatura. Indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor.
* Capilaridad: es la cualidad que posee una sustancia de absorber a otra.
* Compresibilidad: es una propiedad de la materia a la cual se debe que todos los cuerpos disminuyan de volumen al someterlos a una presión o compresión determinada manteniendo constantes otros parámetros. Los sólidos a nivel molecular no se pueden comprimir
* Conductividad eléctrica: es la capacidad de un cuerpo de permitir el paso de la corriente eléctrica a través de sí. Según esta condición los materiales se clasifican en conductores, aislantes y semiconductores.
* Conductividad térmica: es la capacidad de los materiales para dejar pasar el calor
* Dureza: dificultad que oponen los cuerpos a ser rayados. La dureza se mide con unos instrumentos llamados durómetros y existen diferentes escalas de dureza Brinell, Rockwell, Vickers, etc
* Divisibilidad: propiedad en virtud de la cual los cuerpos sólidos pueden fraccionarse hasta el límite molecular.
* Ductilidad: propiedad que tienen algunos metales y aleaciones cuando, bajo la acción de una fuerza, pueden estirarse sin romperse permitiendo obtener alambres o hilos. A los metales que presentan esta propiedad se les denomina dúctiles. Los metales más dúctiles son el platino, oro y cobre. El cobre se utiliza principalmente para fabricar cables eléctricos , porque a su buena ductilidad añade el hecho de que sea muy buen conductor de la electricidad
* Elasticidad: designa la propiedad mecánica de ciertos materiales de sufrir deformaciones reversibles cuando se encuentra sujetos a la acción de fuerzas exteriores y de recuperar la forma original si estas fuerzas exteriores se eliminan
* Extensión: capacidad para ocupar una parte de espacio. (superficie, volumen, longitud)
* Fragilidad: propiedad de la materia que indica con que facilidad se puede romper un cuerpo al sufrir un golpe ligero. la propiedad opuesta a la fragilidad es la tenacidad.
* Impenetrabilidad: propiedad que impide que un cuerpo esté en el lugar que ocupa otro.
* Inercia: resistencia que opone un cuerpo para salir de su estado de reposo, para cambiar las condiciones de movimiento o cesar en él sin aplicación de alguna fuerza.
* Magnetismo: propiedad que tienen algunos metales para a atraer al hierro. El acero puede convertirse en imán si se desea. También se pueden producir electroimanes.
* Maleabilidad: propiedad que tienen algunos materiales para formar láminas muy finas. El oro es un metal de una extraordinaria maleabilidad permitiendo láminas de solo unas milésimas de milímetros. La plata y el cobre también son muy maleables, así como la hojalata, que es una aleación de hierro y estaño
* Mecanibilidad es la propiedad que tienen algunos materiales para ser mecanizados con procedimientos de arranque de viruta.
* Óptica determina como pasa la luz a través de los sólidos. Pueden ser transparente, traslúcido u opacos
* Ósmosis. Es un fenómeno que consiste en el paso del solvente de una disolución desde una zona de baja concentración de soluto a una de alta concentración del soluto, separadas por una membrana semipermeable.
* Pesantez presión sobre los cuerpos sobre los que se apoya o tensión sobre los que prende.
* Peso específico Muchas veces se confunde con densidad. Es la relación entre el peso del cuerpo y su volumen.Peso específico = Peso/Volumen, Pe=P/V. El peso específico de una sustancia se define como el peso por unidad de volumen. Otra forma muy usada para definir el peso específico es multiplicar su densidad por la aceleracion gravitatoria , Pe= D x g , esta definición se usa mas en la mecánica de fluidos.
* Plasticidad propiedad mecánica de un material, biológico o de otro tipo, de deformarse permanentemente e irreversiblemente cuando se encuentra sometido a tensiones por encima de su rango elástico.
* Porosidad propiedad de tener espacio libre entre sus moléculas y poder absorber líquidos o gases.
* Punto de congelación temperatura a la cual un líquido se convierte en estado sólido
* Punto de ebullición: temperatura a la cual un líquido se convierte en gas
* Punto de fusión es la temperatura a la cual una sustancia pasa del estado sólido al estado líquido.
* Resiliencia: es la cantidad de energía que puede absorber un material, antes de que comience la deformación irreversible, esto es, la deformación plástica.
* Resistencia a la corrosión comportamiento que tienen los materiales al tomar contacto con productos químicos, especialmente ácidos.
* Resistencia mecánica: capacidad que tiene un material de soportar los distintos tipos de esfuerzo que existen sin deformarse permanentemente.
* Resistencia a la oxidación comportamiento que tienen los materiales ante el oxígeno de la atmósfera y el contacto con el agua.
* Soldabilidad es la propiedad que tienen algunos materiales para poder ser soldados
* Templabilidad aptitud que tienen algunos metales para adquirir temple por tratamiento térmico. Está dada por la penetración y distribución de la dureza adquirida por el material.
* Tenacidad: es la resistencia que opone un mineral u otro material a ser roto, molido, doblado o desgarrado, siendo una medida de su cohesión. El acero es un material muy tenaz, especialmente alguna de sus aleaciones.

Estructura Atómica
En el átomo distinguimos dos partes: el núcleo y la corteza.
- El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón.
Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones. Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z.
- La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón.
Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Así, el número atómico también coincide con el número de electrones.
Modelo de átomo de He (isótopo 4-He)
Isótopos
La suma del número de protones y el número de neutrones de un átomo recibe el nombre de número másico y se representa con la letra A. Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, pueden tener distinto número de neutrones.
Llamamos isótopos a las formas atómicas de un mismo elemento que se diferencian en su número másico.
Para representar un isótopo, hay que indicar el número másico (A) propio del isótopo y el número atómico (Z), colocados como índice y subíndice, respectivamente, a la izquierda del símbolo del elemento.

TABLA PERIODICA

Recapitulación Viernes 29/Oct
El martes realizamos el experimento con varias sustancias químicas, convinadas con agua, la cual dio diferentes resultados segun lo que se le agregara, despues de esto se les agrego acido sulfurico, clorhirico y tambien diferentes hidroxido de sodio y amonio, con los cuales tuvieron diferentes reacciones como sedimentacion en el fondo.
El jueves vimos lo que son los modelos atómicos y para ello realizamos una práctica cotando una hoja de periódico en tantos pedacitos se pudieran, despues de ello, construimos un pequeño cubo y dentro de el colocamos unas "semillas redondas"para calcular cuantas cabían.
El jueves vimos lo que son los modelos atómicos y para ello realizamos una práctica cotando una hoja de periódico en tantos pedacitos se pudieran, despues de ello, construimos un pequeño cubo y dentro de el colocamos unas "semillas redondas"para calcular cuantas cabían.
Una vez clasificados los elementos se sugiere hacer preguntas como las
Siguientes:
¿Por qué unos elementos son metálicos y otros no metálicos?,
¿Cómo la estructura de los átomos de los elementos nos permite explicar lo anterior?
Investigación bibliográfica sobre el descubrimiento del electrón, protón y neutrón y sobre los modelos atómicos de Thomson, de Rutherford y de Bohr.
(A20)
Durante los siglos VI a IV antes de Cristo, en las ciudades griegas surgió una nueva mentalidad, una nueva forma de ver el mundo no como algo controlado por los dioses y manejado a su capricho, sino como una inmensa máquina gobernada por una leyes fijas e inmutables que el hombre podía llegar a comprender. Fue esta corriente de pensamiento la que puso las bases de la matemática y las ciencias experimentales.
Demócrito, uno de estos pensadores griego, en al siglo IV antes de Cristo, se interrogó sobre la divisibilidad de la materia. A simple vista las sustancias son continuas y se pueden dividir. ¿Es posible dividir una sustancia indefinidamente? Demócrito pensaba que no, que llegaba un momento en que se obtenían unas partículas que no podían ser divididas más; a esas partículas las denominó átomos, que en griego significa indivisible. Cada elemento tenía un átomo con unas propiedades y forma específicas, distintas de las de los átomos de los otros elementos.
De todos los dioses Hefesto era el único que trabajaba, su labor constante en la fragua y el yunque, forjando utensilios, armas, autómatas e incluso los rayos de Zeus, hizo que fuera el dios de la técnica y con ella de la civilización.
Las ideas de Demócrito, sin estar olvidadas completamente, cayeron en desuso durante más de dos mil años.
Mientras tanto, se desarrolló la química, se descubrieron nuevos elementos y se descubrieron las leyes que gobiernan las transformaciones químicas.
Precisamente para explicar algunas de estas leyes, las leyes ponderales.

Símbolos convencionales propuestos por Dalton
Equipo divisiones
1 15
2 16
3 18
4 18
5 18
6 15
Dalton, en 1808 propuso una nueva teoría atómica. Según esta teoría, los elementos estaban formados por átomos, indivisibles e indestructibles, todos iguales entre sí, pero distintos de los átomos de los otros elementos. la unión de los átomos daba lugar a la variedad de sustancias conocidas y la ruptura de las uniones entre los átomos para formar nuevas uniones era el origen de las transformaciones químicas.

Pila de Volta
Cuando en 1800 el italiano Volta descubrió la pila eléctrica, los químicos tuvieron una fuente continua de electricidad y se descubrieron muchos nuevos elementos gracias a ella. También se descubrió que algunas sustancias, como la sal, al disolverse en agua, podían transmitir la electricidad, mientras que otras, como el azúcar, no lo hacían.
El físico y químico inglés Faraday, en la primera mitad del siglo XIX, estableció las leyes de la electroquímica, poniendo en relación cuantitativa algunas transformaciones químicas y la electricidad e intentó hacer pasar electricidad a través del vacío (lo que demostraría la existencia de partículas de electricidad), fracasando al no lograr un vacío lo bastante perfecto.
A finales del siglo XIX Crookes obtuvo un vacío suficiente, observó que al someter en el vacío unas placas metálicas a una gran diferencia de potencial, unas partículas, con carga negativa, que se llamaron electrones, abandonaban la placa cargada negativamente y se movían hacia la que tenía carga positiva. Esas mismas partículas aparecían si se iluminaba un metal con luz ultravioleta. Estaba claro que sólo podían proceder de los átomos del metal, así que el átomo no era indivisible, estaba formado por partículas.
El físico inglés Thomson creyó que el átomo estaba formado por una esfera de carga positiva en la que se engastaban, como pasas en un pastel, los electrones.
pero su propio discípulo Rutherford, descubrió que no podía ser así, que toda la la carga positiva del átomo y casi toda su masa se encontraba en un reducido espacio, el núcleo atómico, mientras que su carga negativa de electrones estaban muy lejos de él, girando a su alrededor, de forma que la mayor parte del átomo estaba vacío (a escala, si el átomo tuviera el tamaño de una plaza de toros, el núcleo tendría el tamaño de un grano de arena). Posteriores investigaciones determinaron que el núcleo atómico estaba formado por dos tipos de partículas, los protones, de carga positiva, y los neutrones, sin carga eléctrica.

Átomo de Thomson

Átomo de Rutherford
En 1860, los físicos alemanes Bunsen y Kirchhoff descubrieron que cada átomo, sin importar su estado, al ser calentado emite una luz de colores característica, los espectros atómicos. Gracias a su invención, se descubrió el elemento Helio, que se emplea en los globos, en el Sol, antes de sospecharse su existencia en la Tierra.
El físico danés Bohr, en 1913, explicó la existencia de los espectros atómicos suponiendo que los electrones no giran en torno al núcleo atómico en cualquier forma, sino que las órbitas de los electrones están cuantizadas mediante 3 números:
el número cuántico principal, n, que determina la distancia al núcleo, el radio de la órbita; el número cuántico azimutal, l, que determina la excentricidad de la órbita; y el número cuántico magnético, m, que determina su orientación en el espacio. Con posterioridad se añadió un cuarto número cuántico, el número cuántico de spín, s, que indica la rotación del electrón sobre si mismo.
Un átomo emitía o absorbía luz cuando un electrón pasaba de una órbita a otra Y no podían existir dos electrones en el mismo átomo, con los cuatro números cuánticos iguales.
Ya en la década de 1920 se propuso, gracias a los esfuerzos de Schrödinger, Heisenberg y el propio Bohr, la teoría de la mecánica cuántica, que da explicación del comportamiento de los electrones y átomos individualmente, en compuestos y en las transformaciones químicas...

Modelo Atómico de Dalton
Elaborar un cubo de tres por tres centímetros, colocar dentro del cubo las esferas solidas (atomos).

Equipo Tamaño de la esfera numero
1 grande 4
2 grande 2
3 pequeña 45
4 grandes 4
5 Pequeña 55
6 pequeña 45
División del aire en sus componentes
Material: Tubo de ensaye de 20 x 200 mm, vaso de precipitados de 250 ml, o cuba hidroneumática
Sustancias: velas, cerillos
Procedimiento:
-Colocar la vela dentro del vaso de precipitados, (fijar con la parafina al fondo del vaso).
-Colocar tres centímetros de altura de agua.
-Encender la vela.
-Cubrir la vela con el tubo de ensaye y observar los cambios ocurridos.
Observaciones:
La vela se fue apagando poco a poco por la falta de oxigeno.
Conclusiones:
Se formaron el dióxido de carbono y dióxido de nitrógeno.
Siguientes:
¿Por qué unos elementos son metálicos y otros no metálicos?,
¿Cómo la estructura de los átomos de los elementos nos permite explicar lo anterior?
Investigación bibliográfica sobre el descubrimiento del electrón, protón y neutrón y sobre los modelos atómicos de Thomson, de Rutherford y de Bohr.
(A20)
Durante los siglos VI a IV antes de Cristo, en las ciudades griegas surgió una nueva mentalidad, una nueva forma de ver el mundo no como algo controlado por los dioses y manejado a su capricho, sino como una inmensa máquina gobernada por una leyes fijas e inmutables que el hombre podía llegar a comprender. Fue esta corriente de pensamiento la que puso las bases de la matemática y las ciencias experimentales.
Demócrito, uno de estos pensadores griego, en al siglo IV antes de Cristo, se interrogó sobre la divisibilidad de la materia. A simple vista las sustancias son continuas y se pueden dividir. ¿Es posible dividir una sustancia indefinidamente? Demócrito pensaba que no, que llegaba un momento en que se obtenían unas partículas que no podían ser divididas más; a esas partículas las denominó átomos, que en griego significa indivisible. Cada elemento tenía un átomo con unas propiedades y forma específicas, distintas de las de los átomos de los otros elementos.
De todos los dioses Hefesto era el único que trabajaba, su labor constante en la fragua y el yunque, forjando utensilios, armas, autómatas e incluso los rayos de Zeus, hizo que fuera el dios de la técnica y con ella de la civilización.
Las ideas de Demócrito, sin estar olvidadas completamente, cayeron en desuso durante más de dos mil años.
Mientras tanto, se desarrolló la química, se descubrieron nuevos elementos y se descubrieron las leyes que gobiernan las transformaciones químicas.
Precisamente para explicar algunas de estas leyes, las leyes ponderales.

Símbolos convencionales propuestos por Dalton
Equipo divisiones
1 15
2 16
3 18
4 18
5 18
6 15
Dalton, en 1808 propuso una nueva teoría atómica. Según esta teoría, los elementos estaban formados por átomos, indivisibles e indestructibles, todos iguales entre sí, pero distintos de los átomos de los otros elementos. la unión de los átomos daba lugar a la variedad de sustancias conocidas y la ruptura de las uniones entre los átomos para formar nuevas uniones era el origen de las transformaciones químicas.

Pila de Volta
Cuando en 1800 el italiano Volta descubrió la pila eléctrica, los químicos tuvieron una fuente continua de electricidad y se descubrieron muchos nuevos elementos gracias a ella. También se descubrió que algunas sustancias, como la sal, al disolverse en agua, podían transmitir la electricidad, mientras que otras, como el azúcar, no lo hacían.
El físico y químico inglés Faraday, en la primera mitad del siglo XIX, estableció las leyes de la electroquímica, poniendo en relación cuantitativa algunas transformaciones químicas y la electricidad e intentó hacer pasar electricidad a través del vacío (lo que demostraría la existencia de partículas de electricidad), fracasando al no lograr un vacío lo bastante perfecto.
A finales del siglo XIX Crookes obtuvo un vacío suficiente, observó que al someter en el vacío unas placas metálicas a una gran diferencia de potencial, unas partículas, con carga negativa, que se llamaron electrones, abandonaban la placa cargada negativamente y se movían hacia la que tenía carga positiva. Esas mismas partículas aparecían si se iluminaba un metal con luz ultravioleta. Estaba claro que sólo podían proceder de los átomos del metal, así que el átomo no era indivisible, estaba formado por partículas.
El físico inglés Thomson creyó que el átomo estaba formado por una esfera de carga positiva en la que se engastaban, como pasas en un pastel, los electrones.
pero su propio discípulo Rutherford, descubrió que no podía ser así, que toda la la carga positiva del átomo y casi toda su masa se encontraba en un reducido espacio, el núcleo atómico, mientras que su carga negativa de electrones estaban muy lejos de él, girando a su alrededor, de forma que la mayor parte del átomo estaba vacío (a escala, si el átomo tuviera el tamaño de una plaza de toros, el núcleo tendría el tamaño de un grano de arena). Posteriores investigaciones determinaron que el núcleo atómico estaba formado por dos tipos de partículas, los protones, de carga positiva, y los neutrones, sin carga eléctrica.

Átomo de Thomson

Átomo de Rutherford
En 1860, los físicos alemanes Bunsen y Kirchhoff descubrieron que cada átomo, sin importar su estado, al ser calentado emite una luz de colores característica, los espectros atómicos. Gracias a su invención, se descubrió el elemento Helio, que se emplea en los globos, en el Sol, antes de sospecharse su existencia en la Tierra.
El físico danés Bohr, en 1913, explicó la existencia de los espectros atómicos suponiendo que los electrones no giran en torno al núcleo atómico en cualquier forma, sino que las órbitas de los electrones están cuantizadas mediante 3 números:
el número cuántico principal, n, que determina la distancia al núcleo, el radio de la órbita; el número cuántico azimutal, l, que determina la excentricidad de la órbita; y el número cuántico magnético, m, que determina su orientación en el espacio. Con posterioridad se añadió un cuarto número cuántico, el número cuántico de spín, s, que indica la rotación del electrón sobre si mismo.
Un átomo emitía o absorbía luz cuando un electrón pasaba de una órbita a otra Y no podían existir dos electrones en el mismo átomo, con los cuatro números cuánticos iguales.
Ya en la década de 1920 se propuso, gracias a los esfuerzos de Schrödinger, Heisenberg y el propio Bohr, la teoría de la mecánica cuántica, que da explicación del comportamiento de los electrones y átomos individualmente, en compuestos y en las transformaciones químicas...

Modelo Atómico de Dalton
Elaborar un cubo de tres por tres centímetros, colocar dentro del cubo las esferas solidas (atomos).

Equipo Tamaño de la esfera numero
1 grande 4
2 grande 2
3 pequeña 45
4 grandes 4
5 Pequeña 55
6 pequeña 45
División del aire en sus componentes
Material: Tubo de ensaye de 20 x 200 mm, vaso de precipitados de 250 ml, o cuba hidroneumática
Sustancias: velas, cerillos
Procedimiento:
-Colocar la vela dentro del vaso de precipitados, (fijar con la parafina al fondo del vaso).
-Colocar tres centímetros de altura de agua.
-Encender la vela.
-Cubrir la vela con el tubo de ensaye y observar los cambios ocurridos.
Observaciones:
La vela se fue apagando poco a poco por la falta de oxigeno.
Conclusiones:
Se formaron el dióxido de carbono y dióxido de nitrógeno.
¿Cómo actúa el oxígeno del aire sobre los elementos?
¿Cómo actúa el oxígeno del aire sobre los elementos?
Nomenclatura química de los compuestos:
Metal mas oxigeno produce oxido
Na + O ------- Na2O oxido de sodio
No metal + oxigeno produce anhídrido
C + O ------ CO monóxido de carbono
Oxido metálico mas agua produce hidróxido
Na2O + H2O ------ NaOH
Anhídrido mas agua produce oxácido
CO + H2O ----- H2CO2 Acido carbonoso
Hidróxido mas oxácido produce sal más agua
NaOH + H2CO2 ----- Na2CO2 Carbonito de sodio + H2O
Metal + Hidrogeno produce hidruro
Na + H --- NaH Hidruro de sodio
No metal mas hidrogeno produce Hidrácido
Cl + H ---- HCl acido clorhídrico.
Nomenclatura química de los compuestos
Material: Matraz erlenmeyer de 250 ml, agitador de vidrio
Sustancias: sólidas y líquidas.
Procedimiento:
- Colocar 200 ml de agua en el matraz erlenmeyer
- Adicionar una muestra de cada sustancia solida, anotando en el cuadro el nombre formula color antes y después de disolver en el agua del matraz.

Suscribirse a:
Entradas (Atom)