Recapitulación 14
Equipo 1
El día martes 9 de noviemre revisamos el tema de las propiedades periódicas y un profesor nos vino a mostrar cual es la reacción del nitrogeno líquido con algunos objetos y observamos que debido a su baja temperatura, congeló dichos objetos y al momento de ponerlos a temperatura ambiente, después de un rato, regresaron a su estado natural.
El día jueves 11 de noviembre vimos la estructura de Lewis de cada familia de la tabla periódica y sus enlaces químicos, después realizamos una práctica en la cual observamos la conductividad electrica y eltipo de enlace que tienen algunas sustancias.
Blog para la materia de Química II en el CCH Sur!!
Equipoo 1! Grupo 206 Sección B
Profe: Manuel Agustín García López
^^
>>González Diego Laura Rigel<< ☻
Equipoo 1! Grupo 206 Sección B
Profe: Manuel Agustín García López
^^
>>González Diego Laura Rigel<< ☻
lunes, 22 de noviembre de 2010
miércoles, 17 de noviembre de 2010
Representación de los Electrones de Valencia
¿Que son y cómo se representan los electrones de valencia?
Los electrones de valencia son los electrones que se encuentran ubicados en la última capa o nivel energético de determinado átomo. Se llaman así porque estos determinan la valencia o número de oxidación de determinado elemento.
Y se representan por la estructura de Lewis:

Escribir la estructura de Lewis de cada Familia.

• En química, el enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
• Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
• En un enlace metálico, los electrones de enlace están des localizados en una estructura de átomos. En contraste, en los compuestos iónicos, la ubicación de los electrones enlazantes y sus cargas es estática. Debido a la deslocalización o el libre movimiento de los electrones, se tienen las propiedades metálicas de conductividad, ductilidad y dureza.
Determinación del tipo de enlace químico.
Material: Probador de conductividad eléctrica, capsula de porcelana.
Sustancias: Cloruro de sodio, sacarosa, metales, agua, alcohol.
Procedimiento:
a.- Colocar en la capsula de porcelana una muestra del cloruro de sodio, probar su conductividad eléctrica en seco, agregar unas gotas de agua y probar nuevamente su conductividad eléctrica. Anotar las observaciones.
b.- Repetir el paso a con las demás sustancias.
c.- Observaciones:

Conclusiones:
Con los experimentos realizados vimos los diferentes tipos de enlaces que hay como son el iónico al prestar uno de sus electrones para formar la capa de valencia, el covalente compartir los electrones y el metálico es la nube electrónica que permite el paso de la corriente eléctrica.


Los electrones de valencia son los electrones que se encuentran ubicados en la última capa o nivel energético de determinado átomo. Se llaman así porque estos determinan la valencia o número de oxidación de determinado elemento.
Y se representan por la estructura de Lewis:

Escribir la estructura de Lewis de cada Familia.

• En química, el enlace iónico es una unión que resulta de la presencia de fuerza de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
• Un enlace covalente se produce por compartición de electrones entre dos átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
• En un enlace metálico, los electrones de enlace están des localizados en una estructura de átomos. En contraste, en los compuestos iónicos, la ubicación de los electrones enlazantes y sus cargas es estática. Debido a la deslocalización o el libre movimiento de los electrones, se tienen las propiedades metálicas de conductividad, ductilidad y dureza.
Determinación del tipo de enlace químico.
Material: Probador de conductividad eléctrica, capsula de porcelana.
Sustancias: Cloruro de sodio, sacarosa, metales, agua, alcohol.
Procedimiento:
a.- Colocar en la capsula de porcelana una muestra del cloruro de sodio, probar su conductividad eléctrica en seco, agregar unas gotas de agua y probar nuevamente su conductividad eléctrica. Anotar las observaciones.
b.- Repetir el paso a con las demás sustancias.
c.- Observaciones:

Conclusiones:
Con los experimentos realizados vimos los diferentes tipos de enlaces que hay como son el iónico al prestar uno de sus electrones para formar la capa de valencia, el covalente compartir los electrones y el metálico es la nube electrónica que permite el paso de la corriente eléctrica.


Propiedades Periódicas de los Elementos
Indagación Bibliográfica 08-12 Nov
UNIDAD 2
SEXTA SEMANA
Propiedades Periódicas
Una de las ventajas de la Tabla Periódica es que permite predecir las propiedades de los elementos con sólo ver su posición dentro de ella. Además se debe mencionar que la tabla periódica permite realizar comparaciones entre diferentes propiedades de los elementos. Estas propiedades se conocen como PROPIEDADES PERIÓDICAS. Las principales propiedades periódicas son: volumen atómico, potencial de ionización, afinidad electrónica y electronegatividad.
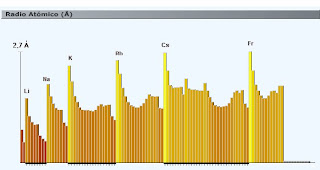
# Radio Atómico.
El Radio atómico que es una medida del tamaño atómico decrece a lo largo de un período y aumenta al ir bajando de período (Niveles superiores). La explicación de ésto es que el núcleo va aumentando de carga para un mismo período por lo que los electrones son más fuertemente atraídos hacia el núcleo. El radio atómico aumenta al añadir un nuevo nivel de energía.
La distancia de los electrones más externos al núcleo. Esta distancia se mide
en Angström (A=10-8), dentro de un grupo Sistema periódico, a medida que aumenta el número atómico de los miembros de una familia aumenta la densidad, ya que la masa atómica crece mas que el volumen atómico, el color F (gas amarillo verdoso), Cl (gas verde),
Br (líquido rojo), I sólido (negro púrpura), el lumen y el radio atómico, el carácter metálico, el radio iónico, aunque el radio iónico de los elementos metálicos es menor que su radio atómico.
# Energía de Ionización
Se conoce como primera energía de ionización a la energía necesaria para separar el electrón más externo de un átomo neutro en estado gaseoso sin proporcionarle energía cinética.
Según esta definición, E.I. dependerá de tres factores: la distancia del electrón al núcleo, la carga nuclear y el efecto pantalla.
Emplea el método de Slater para calcular las afinidades electrónicas de los elementos del segundo período y compara sus resultados con los experimentales de la tabla 9.5 del Cruz,Chamizo & Garritz (Mr. Profe & Jefe). ¿Qué puedes comentar al respecto?
La variación de la energía de ionización se explica a continuación:
Dentro de un mismo grupo la E.I. disminuye de arriba a abajo. Esto se debe a que conforme descendemos en la tabla periódica los átomos tienen más electrones, lo cual disminuye la atracción sobre el electrón más externo (efecto pantalla).
En un mismo periodo la E.I. aumenta de izquierda a derecha. Este comportamiento se explica debido a que conforme avanzamos de izquierda a derecha, el electrón externo del átomo está menos alejado del núcleo y por tanto la fuerza con la cual es atrído aumenta. (distancia al núcleo, radio atómico).
Una regla empírica que relaciona en forma aproximada los valores de
altas energías de ionización sucesivas de electrones que ocupan la misma capa atómica es In = (n+1)/n * I(n-1) Utilizando el dato experimental de I3, estima con ella el valor de I4 para estaño, antimonio, telurio y yodo, y discute su validez.
# Electro-Afinidad
Energía desprendida por un ion gaseoso que recibe un electrón y pasa a átomos gaseosos, es igual el valor al potencial de ionización y disminuye al aumentar el número atómico de los miembros de una familia. La electronegatividad es la tendencia de un átomo a captar electrones. En una familia disminuye con el número
atómico y en un período aumenta con el número atómico.
Otra definición sería que el cambio de Energía Asociado con el proceso con el cual un electrón se agrega a un átomo gaseoso en estado fundamental.
Electronegatividad: Medida de la capacidad relativa de un átomo en una molécula para atraer electrones hacia él mismo.
# Electro Negatividad
La electronegatividad es la capacidad que tienen los elementos de atraer hacia sí los electrones de enlace.
La electronegatividad varía de la siguiente forma:
Para un mismo grupo la electronegatividad disminuye de arriba hacia abajo.
En un mismo periodo la electronegatividad aumenta de izquierda a derecha.
SEXTA SEMANA
Propiedades Periódicas
Una de las ventajas de la Tabla Periódica es que permite predecir las propiedades de los elementos con sólo ver su posición dentro de ella. Además se debe mencionar que la tabla periódica permite realizar comparaciones entre diferentes propiedades de los elementos. Estas propiedades se conocen como PROPIEDADES PERIÓDICAS. Las principales propiedades periódicas son: volumen atómico, potencial de ionización, afinidad electrónica y electronegatividad.
# Radio Atómico.
El Radio atómico que es una medida del tamaño atómico decrece a lo largo de un período y aumenta al ir bajando de período (Niveles superiores). La explicación de ésto es que el núcleo va aumentando de carga para un mismo período por lo que los electrones son más fuertemente atraídos hacia el núcleo. El radio atómico aumenta al añadir un nuevo nivel de energía.
La distancia de los electrones más externos al núcleo. Esta distancia se mide
en Angström (A=10-8), dentro de un grupo Sistema periódico, a medida que aumenta el número atómico de los miembros de una familia aumenta la densidad, ya que la masa atómica crece mas que el volumen atómico, el color F (gas amarillo verdoso), Cl (gas verde),
Br (líquido rojo), I sólido (negro púrpura), el lumen y el radio atómico, el carácter metálico, el radio iónico, aunque el radio iónico de los elementos metálicos es menor que su radio atómico.
# Energía de Ionización
Se conoce como primera energía de ionización a la energía necesaria para separar el electrón más externo de un átomo neutro en estado gaseoso sin proporcionarle energía cinética.
Según esta definición, E.I. dependerá de tres factores: la distancia del electrón al núcleo, la carga nuclear y el efecto pantalla.
Emplea el método de Slater para calcular las afinidades electrónicas de los elementos del segundo período y compara sus resultados con los experimentales de la tabla 9.5 del Cruz,Chamizo & Garritz (Mr. Profe & Jefe). ¿Qué puedes comentar al respecto?
La variación de la energía de ionización se explica a continuación:
Dentro de un mismo grupo la E.I. disminuye de arriba a abajo. Esto se debe a que conforme descendemos en la tabla periódica los átomos tienen más electrones, lo cual disminuye la atracción sobre el electrón más externo (efecto pantalla).
En un mismo periodo la E.I. aumenta de izquierda a derecha. Este comportamiento se explica debido a que conforme avanzamos de izquierda a derecha, el electrón externo del átomo está menos alejado del núcleo y por tanto la fuerza con la cual es atrído aumenta. (distancia al núcleo, radio atómico).
Una regla empírica que relaciona en forma aproximada los valores de
altas energías de ionización sucesivas de electrones que ocupan la misma capa atómica es In = (n+1)/n * I(n-1) Utilizando el dato experimental de I3, estima con ella el valor de I4 para estaño, antimonio, telurio y yodo, y discute su validez.
# Electro-Afinidad
Energía desprendida por un ion gaseoso que recibe un electrón y pasa a átomos gaseosos, es igual el valor al potencial de ionización y disminuye al aumentar el número atómico de los miembros de una familia. La electronegatividad es la tendencia de un átomo a captar electrones. En una familia disminuye con el número
atómico y en un período aumenta con el número atómico.
Otra definición sería que el cambio de Energía Asociado con el proceso con el cual un electrón se agrega a un átomo gaseoso en estado fundamental.
Electronegatividad: Medida de la capacidad relativa de un átomo en una molécula para atraer electrones hacia él mismo.
# Electro Negatividad
La electronegatividad es la capacidad que tienen los elementos de atraer hacia sí los electrones de enlace.
La electronegatividad varía de la siguiente forma:
Para un mismo grupo la electronegatividad disminuye de arriba hacia abajo.
En un mismo periodo la electronegatividad aumenta de izquierda a derecha.
lunes, 15 de noviembre de 2010
Recapitulación Viernes 5/Nov
Recapitulación
Equipo 1
El día martes 2 de noviembre no asistimos a clases.
El día jueves 4 de noviembre revisamos varios temas como el de las propiedades físicas de los metales y no metales, la estructura atómica de los metales principales, también vimos dos videos relacionados con los temas anteriores y por último el profesor nos mostró que pasa cuando se aplica energía a los no metales.
Equipo 1
El día martes 2 de noviembre no asistimos a clases.
El día jueves 4 de noviembre revisamos varios temas como el de las propiedades físicas de los metales y no metales, la estructura atómica de los metales principales, también vimos dos videos relacionados con los temas anteriores y por último el profesor nos mostró que pasa cuando se aplica energía a los no metales.
domingo, 7 de noviembre de 2010
¿Cuáles son las Propiedades Físicas de los metales y no-metales.?
Indagación Bibliográfica 01-05 Nov
UNIDAD 2
QUINTA SEMANA
Propiedades Físicas
Las propiedades físicas son aquellas en las que se mantienen las propiedades originales de la sustancia ya que sus moléculas no se modifican.
Propiedades específicas de los sólidos
* Adherencia: atracción o unión entre las moléculas próximas de los cuerpos.
* Aleabilidad: propiedad que tienen los materiales para formar aleaciones que dan lugar a nuevos materiales mejorando sus prestaciones. En todas las aleaciones un componente como mínimo tiene que ser un metal.
* Calor específico. La capacidad calorífica o calor específico de una sustancia es la cantidad de energía necesaria para aumentar 1 ºC su temperatura. Indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor.
* Capilaridad: es la cualidad que posee una sustancia de absorber a otra.
* Compresibilidad: es una propiedad de la materia a la cual se debe que todos los cuerpos disminuyan de volumen al someterlos a una presión o compresión determinada manteniendo constantes otros parámetros. Los sólidos a nivel molecular no se pueden comprimir
* Conductividad eléctrica: es la capacidad de un cuerpo de permitir el paso de la corriente eléctrica a través de sí. Según esta condición los materiales se clasifican en conductores, aislantes y semiconductores.
* Conductividad térmica: es la capacidad de los materiales para dejar pasar el calor
* Dureza: dificultad que oponen los cuerpos a ser rayados. La dureza se mide con unos instrumentos llamados durómetros y existen diferentes escalas de dureza Brinell, Rockwell, Vickers, etc
* Divisibilidad: propiedad en virtud de la cual los cuerpos sólidos pueden fraccionarse hasta el límite molecular.
* Ductilidad: propiedad que tienen algunos metales y aleaciones cuando, bajo la acción de una fuerza, pueden estirarse sin romperse permitiendo obtener alambres o hilos. A los metales que presentan esta propiedad se les denomina dúctiles. Los metales más dúctiles son el platino, oro y cobre. El cobre se utiliza principalmente para fabricar cables eléctricos , porque a su buena ductilidad añade el hecho de que sea muy buen conductor de la electricidad
* Elasticidad: designa la propiedad mecánica de ciertos materiales de sufrir deformaciones reversibles cuando se encuentra sujetos a la acción de fuerzas exteriores y de recuperar la forma original si estas fuerzas exteriores se eliminan
* Extensión: capacidad para ocupar una parte de espacio. (superficie, volumen, longitud)
* Fragilidad: propiedad de la materia que indica con que facilidad se puede romper un cuerpo al sufrir un golpe ligero. la propiedad opuesta a la fragilidad es la tenacidad.
* Impenetrabilidad: propiedad que impide que un cuerpo esté en el lugar que ocupa otro.
* Inercia: resistencia que opone un cuerpo para salir de su estado de reposo, para cambiar las condiciones de movimiento o cesar en él sin aplicación de alguna fuerza.
* Magnetismo: propiedad que tienen algunos metales para a atraer al hierro. El acero puede convertirse en imán si se desea. También se pueden producir electroimanes.
* Maleabilidad: propiedad que tienen algunos materiales para formar láminas muy finas. El oro es un metal de una extraordinaria maleabilidad permitiendo láminas de solo unas milésimas de milímetros. La plata y el cobre también son muy maleables, así como la hojalata, que es una aleación de hierro y estaño
* Mecanibilidad es la propiedad que tienen algunos materiales para ser mecanizados con procedimientos de arranque de viruta.
* Óptica determina como pasa la luz a través de los sólidos. Pueden ser transparente, traslúcido u opacos
* Ósmosis. Es un fenómeno que consiste en el paso del solvente de una disolución desde una zona de baja concentración de soluto a una de alta concentración del soluto, separadas por una membrana semipermeable.
* Pesantez presión sobre los cuerpos sobre los que se apoya o tensión sobre los que prende.
* Peso específico Muchas veces se confunde con densidad. Es la relación entre el peso del cuerpo y su volumen.Peso específico = Peso/Volumen, Pe=P/V. El peso específico de una sustancia se define como el peso por unidad de volumen. Otra forma muy usada para definir el peso específico es multiplicar su densidad por la aceleracion gravitatoria , Pe= D x g , esta definición se usa mas en la mecánica de fluidos.
* Plasticidad propiedad mecánica de un material, biológico o de otro tipo, de deformarse permanentemente e irreversiblemente cuando se encuentra sometido a tensiones por encima de su rango elástico.
* Porosidad propiedad de tener espacio libre entre sus moléculas y poder absorber líquidos o gases.
* Punto de congelación temperatura a la cual un líquido se convierte en estado sólido
* Punto de ebullición: temperatura a la cual un líquido se convierte en gas
* Punto de fusión es la temperatura a la cual una sustancia pasa del estado sólido al estado líquido.
* Resiliencia: es la cantidad de energía que puede absorber un material, antes de que comience la deformación irreversible, esto es, la deformación plástica.
* Resistencia a la corrosión comportamiento que tienen los materiales al tomar contacto con productos químicos, especialmente ácidos.
* Resistencia mecánica: capacidad que tiene un material de soportar los distintos tipos de esfuerzo que existen sin deformarse permanentemente.
* Resistencia a la oxidación comportamiento que tienen los materiales ante el oxígeno de la atmósfera y el contacto con el agua.
* Soldabilidad es la propiedad que tienen algunos materiales para poder ser soldados
* Templabilidad aptitud que tienen algunos metales para adquirir temple por tratamiento térmico. Está dada por la penetración y distribución de la dureza adquirida por el material.
* Tenacidad: es la resistencia que opone un mineral u otro material a ser roto, molido, doblado o desgarrado, siendo una medida de su cohesión. El acero es un material muy tenaz, especialmente alguna de sus aleaciones.

Estructura Atómica
En el átomo distinguimos dos partes: el núcleo y la corteza.
- El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón.
Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones. Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z.
- La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón.
Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Así, el número atómico también coincide con el número de electrones.
Modelo de átomo de He (isótopo 4-He)
Isótopos
La suma del número de protones y el número de neutrones de un átomo recibe el nombre de número másico y se representa con la letra A. Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, pueden tener distinto número de neutrones.
Llamamos isótopos a las formas atómicas de un mismo elemento que se diferencian en su número másico.
Para representar un isótopo, hay que indicar el número másico (A) propio del isótopo y el número atómico (Z), colocados como índice y subíndice, respectivamente, a la izquierda del símbolo del elemento.

TABLA PERIODICA

Recapitulación Viernes 29/Oct
El martes realizamos el experimento con varias sustancias químicas, convinadas con agua, la cual dio diferentes resultados segun lo que se le agregara, despues de esto se les agrego acido sulfurico, clorhirico y tambien diferentes hidroxido de sodio y amonio, con los cuales tuvieron diferentes reacciones como sedimentacion en el fondo.
El jueves vimos lo que son los modelos atómicos y para ello realizamos una práctica cotando una hoja de periódico en tantos pedacitos se pudieran, despues de ello, construimos un pequeño cubo y dentro de el colocamos unas "semillas redondas"para calcular cuantas cabían.
El jueves vimos lo que son los modelos atómicos y para ello realizamos una práctica cotando una hoja de periódico en tantos pedacitos se pudieran, despues de ello, construimos un pequeño cubo y dentro de el colocamos unas "semillas redondas"para calcular cuantas cabían.
Una vez clasificados los elementos se sugiere hacer preguntas como las
Siguientes:
¿Por qué unos elementos son metálicos y otros no metálicos?,
¿Cómo la estructura de los átomos de los elementos nos permite explicar lo anterior?
Investigación bibliográfica sobre el descubrimiento del electrón, protón y neutrón y sobre los modelos atómicos de Thomson, de Rutherford y de Bohr.
(A20)
Durante los siglos VI a IV antes de Cristo, en las ciudades griegas surgió una nueva mentalidad, una nueva forma de ver el mundo no como algo controlado por los dioses y manejado a su capricho, sino como una inmensa máquina gobernada por una leyes fijas e inmutables que el hombre podía llegar a comprender. Fue esta corriente de pensamiento la que puso las bases de la matemática y las ciencias experimentales.
Demócrito, uno de estos pensadores griego, en al siglo IV antes de Cristo, se interrogó sobre la divisibilidad de la materia. A simple vista las sustancias son continuas y se pueden dividir. ¿Es posible dividir una sustancia indefinidamente? Demócrito pensaba que no, que llegaba un momento en que se obtenían unas partículas que no podían ser divididas más; a esas partículas las denominó átomos, que en griego significa indivisible. Cada elemento tenía un átomo con unas propiedades y forma específicas, distintas de las de los átomos de los otros elementos.
De todos los dioses Hefesto era el único que trabajaba, su labor constante en la fragua y el yunque, forjando utensilios, armas, autómatas e incluso los rayos de Zeus, hizo que fuera el dios de la técnica y con ella de la civilización.
Las ideas de Demócrito, sin estar olvidadas completamente, cayeron en desuso durante más de dos mil años.
Mientras tanto, se desarrolló la química, se descubrieron nuevos elementos y se descubrieron las leyes que gobiernan las transformaciones químicas.
Precisamente para explicar algunas de estas leyes, las leyes ponderales.

Símbolos convencionales propuestos por Dalton
Equipo divisiones
1 15
2 16
3 18
4 18
5 18
6 15
Dalton, en 1808 propuso una nueva teoría atómica. Según esta teoría, los elementos estaban formados por átomos, indivisibles e indestructibles, todos iguales entre sí, pero distintos de los átomos de los otros elementos. la unión de los átomos daba lugar a la variedad de sustancias conocidas y la ruptura de las uniones entre los átomos para formar nuevas uniones era el origen de las transformaciones químicas.

Pila de Volta
Cuando en 1800 el italiano Volta descubrió la pila eléctrica, los químicos tuvieron una fuente continua de electricidad y se descubrieron muchos nuevos elementos gracias a ella. También se descubrió que algunas sustancias, como la sal, al disolverse en agua, podían transmitir la electricidad, mientras que otras, como el azúcar, no lo hacían.
El físico y químico inglés Faraday, en la primera mitad del siglo XIX, estableció las leyes de la electroquímica, poniendo en relación cuantitativa algunas transformaciones químicas y la electricidad e intentó hacer pasar electricidad a través del vacío (lo que demostraría la existencia de partículas de electricidad), fracasando al no lograr un vacío lo bastante perfecto.
A finales del siglo XIX Crookes obtuvo un vacío suficiente, observó que al someter en el vacío unas placas metálicas a una gran diferencia de potencial, unas partículas, con carga negativa, que se llamaron electrones, abandonaban la placa cargada negativamente y se movían hacia la que tenía carga positiva. Esas mismas partículas aparecían si se iluminaba un metal con luz ultravioleta. Estaba claro que sólo podían proceder de los átomos del metal, así que el átomo no era indivisible, estaba formado por partículas.
El físico inglés Thomson creyó que el átomo estaba formado por una esfera de carga positiva en la que se engastaban, como pasas en un pastel, los electrones.
pero su propio discípulo Rutherford, descubrió que no podía ser así, que toda la la carga positiva del átomo y casi toda su masa se encontraba en un reducido espacio, el núcleo atómico, mientras que su carga negativa de electrones estaban muy lejos de él, girando a su alrededor, de forma que la mayor parte del átomo estaba vacío (a escala, si el átomo tuviera el tamaño de una plaza de toros, el núcleo tendría el tamaño de un grano de arena). Posteriores investigaciones determinaron que el núcleo atómico estaba formado por dos tipos de partículas, los protones, de carga positiva, y los neutrones, sin carga eléctrica.

Átomo de Thomson

Átomo de Rutherford
En 1860, los físicos alemanes Bunsen y Kirchhoff descubrieron que cada átomo, sin importar su estado, al ser calentado emite una luz de colores característica, los espectros atómicos. Gracias a su invención, se descubrió el elemento Helio, que se emplea en los globos, en el Sol, antes de sospecharse su existencia en la Tierra.
El físico danés Bohr, en 1913, explicó la existencia de los espectros atómicos suponiendo que los electrones no giran en torno al núcleo atómico en cualquier forma, sino que las órbitas de los electrones están cuantizadas mediante 3 números:
el número cuántico principal, n, que determina la distancia al núcleo, el radio de la órbita; el número cuántico azimutal, l, que determina la excentricidad de la órbita; y el número cuántico magnético, m, que determina su orientación en el espacio. Con posterioridad se añadió un cuarto número cuántico, el número cuántico de spín, s, que indica la rotación del electrón sobre si mismo.
Un átomo emitía o absorbía luz cuando un electrón pasaba de una órbita a otra Y no podían existir dos electrones en el mismo átomo, con los cuatro números cuánticos iguales.
Ya en la década de 1920 se propuso, gracias a los esfuerzos de Schrödinger, Heisenberg y el propio Bohr, la teoría de la mecánica cuántica, que da explicación del comportamiento de los electrones y átomos individualmente, en compuestos y en las transformaciones químicas...

Modelo Atómico de Dalton
Elaborar un cubo de tres por tres centímetros, colocar dentro del cubo las esferas solidas (atomos).

Equipo Tamaño de la esfera numero
1 grande 4
2 grande 2
3 pequeña 45
4 grandes 4
5 Pequeña 55
6 pequeña 45
División del aire en sus componentes
Material: Tubo de ensaye de 20 x 200 mm, vaso de precipitados de 250 ml, o cuba hidroneumática
Sustancias: velas, cerillos
Procedimiento:
-Colocar la vela dentro del vaso de precipitados, (fijar con la parafina al fondo del vaso).
-Colocar tres centímetros de altura de agua.
-Encender la vela.
-Cubrir la vela con el tubo de ensaye y observar los cambios ocurridos.
Observaciones:
La vela se fue apagando poco a poco por la falta de oxigeno.
Conclusiones:
Se formaron el dióxido de carbono y dióxido de nitrógeno.
Siguientes:
¿Por qué unos elementos son metálicos y otros no metálicos?,
¿Cómo la estructura de los átomos de los elementos nos permite explicar lo anterior?
Investigación bibliográfica sobre el descubrimiento del electrón, protón y neutrón y sobre los modelos atómicos de Thomson, de Rutherford y de Bohr.
(A20)
Durante los siglos VI a IV antes de Cristo, en las ciudades griegas surgió una nueva mentalidad, una nueva forma de ver el mundo no como algo controlado por los dioses y manejado a su capricho, sino como una inmensa máquina gobernada por una leyes fijas e inmutables que el hombre podía llegar a comprender. Fue esta corriente de pensamiento la que puso las bases de la matemática y las ciencias experimentales.
Demócrito, uno de estos pensadores griego, en al siglo IV antes de Cristo, se interrogó sobre la divisibilidad de la materia. A simple vista las sustancias son continuas y se pueden dividir. ¿Es posible dividir una sustancia indefinidamente? Demócrito pensaba que no, que llegaba un momento en que se obtenían unas partículas que no podían ser divididas más; a esas partículas las denominó átomos, que en griego significa indivisible. Cada elemento tenía un átomo con unas propiedades y forma específicas, distintas de las de los átomos de los otros elementos.
De todos los dioses Hefesto era el único que trabajaba, su labor constante en la fragua y el yunque, forjando utensilios, armas, autómatas e incluso los rayos de Zeus, hizo que fuera el dios de la técnica y con ella de la civilización.
Las ideas de Demócrito, sin estar olvidadas completamente, cayeron en desuso durante más de dos mil años.
Mientras tanto, se desarrolló la química, se descubrieron nuevos elementos y se descubrieron las leyes que gobiernan las transformaciones químicas.
Precisamente para explicar algunas de estas leyes, las leyes ponderales.

Símbolos convencionales propuestos por Dalton
Equipo divisiones
1 15
2 16
3 18
4 18
5 18
6 15
Dalton, en 1808 propuso una nueva teoría atómica. Según esta teoría, los elementos estaban formados por átomos, indivisibles e indestructibles, todos iguales entre sí, pero distintos de los átomos de los otros elementos. la unión de los átomos daba lugar a la variedad de sustancias conocidas y la ruptura de las uniones entre los átomos para formar nuevas uniones era el origen de las transformaciones químicas.

Pila de Volta
Cuando en 1800 el italiano Volta descubrió la pila eléctrica, los químicos tuvieron una fuente continua de electricidad y se descubrieron muchos nuevos elementos gracias a ella. También se descubrió que algunas sustancias, como la sal, al disolverse en agua, podían transmitir la electricidad, mientras que otras, como el azúcar, no lo hacían.
El físico y químico inglés Faraday, en la primera mitad del siglo XIX, estableció las leyes de la electroquímica, poniendo en relación cuantitativa algunas transformaciones químicas y la electricidad e intentó hacer pasar electricidad a través del vacío (lo que demostraría la existencia de partículas de electricidad), fracasando al no lograr un vacío lo bastante perfecto.
A finales del siglo XIX Crookes obtuvo un vacío suficiente, observó que al someter en el vacío unas placas metálicas a una gran diferencia de potencial, unas partículas, con carga negativa, que se llamaron electrones, abandonaban la placa cargada negativamente y se movían hacia la que tenía carga positiva. Esas mismas partículas aparecían si se iluminaba un metal con luz ultravioleta. Estaba claro que sólo podían proceder de los átomos del metal, así que el átomo no era indivisible, estaba formado por partículas.
El físico inglés Thomson creyó que el átomo estaba formado por una esfera de carga positiva en la que se engastaban, como pasas en un pastel, los electrones.
pero su propio discípulo Rutherford, descubrió que no podía ser así, que toda la la carga positiva del átomo y casi toda su masa se encontraba en un reducido espacio, el núcleo atómico, mientras que su carga negativa de electrones estaban muy lejos de él, girando a su alrededor, de forma que la mayor parte del átomo estaba vacío (a escala, si el átomo tuviera el tamaño de una plaza de toros, el núcleo tendría el tamaño de un grano de arena). Posteriores investigaciones determinaron que el núcleo atómico estaba formado por dos tipos de partículas, los protones, de carga positiva, y los neutrones, sin carga eléctrica.

Átomo de Thomson

Átomo de Rutherford
En 1860, los físicos alemanes Bunsen y Kirchhoff descubrieron que cada átomo, sin importar su estado, al ser calentado emite una luz de colores característica, los espectros atómicos. Gracias a su invención, se descubrió el elemento Helio, que se emplea en los globos, en el Sol, antes de sospecharse su existencia en la Tierra.
El físico danés Bohr, en 1913, explicó la existencia de los espectros atómicos suponiendo que los electrones no giran en torno al núcleo atómico en cualquier forma, sino que las órbitas de los electrones están cuantizadas mediante 3 números:
el número cuántico principal, n, que determina la distancia al núcleo, el radio de la órbita; el número cuántico azimutal, l, que determina la excentricidad de la órbita; y el número cuántico magnético, m, que determina su orientación en el espacio. Con posterioridad se añadió un cuarto número cuántico, el número cuántico de spín, s, que indica la rotación del electrón sobre si mismo.
Un átomo emitía o absorbía luz cuando un electrón pasaba de una órbita a otra Y no podían existir dos electrones en el mismo átomo, con los cuatro números cuánticos iguales.
Ya en la década de 1920 se propuso, gracias a los esfuerzos de Schrödinger, Heisenberg y el propio Bohr, la teoría de la mecánica cuántica, que da explicación del comportamiento de los electrones y átomos individualmente, en compuestos y en las transformaciones químicas...

Modelo Atómico de Dalton
Elaborar un cubo de tres por tres centímetros, colocar dentro del cubo las esferas solidas (atomos).

Equipo Tamaño de la esfera numero
1 grande 4
2 grande 2
3 pequeña 45
4 grandes 4
5 Pequeña 55
6 pequeña 45
División del aire en sus componentes
Material: Tubo de ensaye de 20 x 200 mm, vaso de precipitados de 250 ml, o cuba hidroneumática
Sustancias: velas, cerillos
Procedimiento:
-Colocar la vela dentro del vaso de precipitados, (fijar con la parafina al fondo del vaso).
-Colocar tres centímetros de altura de agua.
-Encender la vela.
-Cubrir la vela con el tubo de ensaye y observar los cambios ocurridos.
Observaciones:
La vela se fue apagando poco a poco por la falta de oxigeno.
Conclusiones:
Se formaron el dióxido de carbono y dióxido de nitrógeno.
¿Cómo actúa el oxígeno del aire sobre los elementos?
¿Cómo actúa el oxígeno del aire sobre los elementos?
Nomenclatura química de los compuestos:
Metal mas oxigeno produce oxido
Na + O ------- Na2O oxido de sodio
No metal + oxigeno produce anhídrido
C + O ------ CO monóxido de carbono
Oxido metálico mas agua produce hidróxido
Na2O + H2O ------ NaOH
Anhídrido mas agua produce oxácido
CO + H2O ----- H2CO2 Acido carbonoso
Hidróxido mas oxácido produce sal más agua
NaOH + H2CO2 ----- Na2CO2 Carbonito de sodio + H2O
Metal + Hidrogeno produce hidruro
Na + H --- NaH Hidruro de sodio
No metal mas hidrogeno produce Hidrácido
Cl + H ---- HCl acido clorhídrico.
Nomenclatura química de los compuestos
Material: Matraz erlenmeyer de 250 ml, agitador de vidrio
Sustancias: sólidas y líquidas.
Procedimiento:
- Colocar 200 ml de agua en el matraz erlenmeyer
- Adicionar una muestra de cada sustancia solida, anotando en el cuadro el nombre formula color antes y después de disolver en el agua del matraz.

martes, 26 de octubre de 2010
Indagación Bibliográfica 25-29 Oct
UNIDAD 2
CUARTA SEMANA
Nomenclatura Química
La nomenclatura química (del latín nomenclatūra.) es un conjunto de reglas o formulas que se utilizan para nombrar todos aquellos elementos y los compuestos químicos. Actualmente la IUPAC (Unión Internacional de Química Pura y Aplicada, en inglés International Union of Pure and Applied Chemistry) es la máxima autoridad en materia de nomenclatura química, la cual se encarga de establecer las reglas correspondientes.
Nomenclatura Química de los Compuestos Orgánicos
Este sistema de nomenclatura contiene las reglas y normas para nombrar a los compuestos orgánicos, moléculas compuestas esencialmente por carbono e hidrógeno enlazados con elementos como el oxígeno, el nitrógeno, y con los hálogenos, el azufre y fósforo.
Nomenclatura Química de los Compuestos Inorgánicos
Este sistema de nomenclatura agrupa y nombra a los compuestos inorgánicos que son todos los compuestos diferentes de los orgánicos. Actualmente se aceptan tres sistemas o sub-sistemas de nomenclatura, estos son: el sistema de nomenclatura estequiométrica o sistemático, el sistema de nomenclatura funcional o clásico o tradicional y el sistema de nomenclatura stock. Estos tres sistemas nombran a casi todos los compuestos inorgánicos, siendo la nomenclatura tradicional la más extensa.

Ecuaciones Químicas
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos ó reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas.
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción
La ecuación química nos ayuda a visualizar los reactivos que son los que tendrán una reacción química y el producto que es lo que se obtiene de este proceso. Además podemos ubicar los símbolos químicos de cada uno de los elementos que estén dentro de la ecuación y poder balancearlos con mayor facilidad y gran rapidez.

CUARTA SEMANA
Nomenclatura Química
La nomenclatura química (del latín nomenclatūra.) es un conjunto de reglas o formulas que se utilizan para nombrar todos aquellos elementos y los compuestos químicos. Actualmente la IUPAC (Unión Internacional de Química Pura y Aplicada, en inglés International Union of Pure and Applied Chemistry) es la máxima autoridad en materia de nomenclatura química, la cual se encarga de establecer las reglas correspondientes.
Nomenclatura Química de los Compuestos Orgánicos
Este sistema de nomenclatura contiene las reglas y normas para nombrar a los compuestos orgánicos, moléculas compuestas esencialmente por carbono e hidrógeno enlazados con elementos como el oxígeno, el nitrógeno, y con los hálogenos, el azufre y fósforo.
Nomenclatura Química de los Compuestos Inorgánicos
Este sistema de nomenclatura agrupa y nombra a los compuestos inorgánicos que son todos los compuestos diferentes de los orgánicos. Actualmente se aceptan tres sistemas o sub-sistemas de nomenclatura, estos son: el sistema de nomenclatura estequiométrica o sistemático, el sistema de nomenclatura funcional o clásico o tradicional y el sistema de nomenclatura stock. Estos tres sistemas nombran a casi todos los compuestos inorgánicos, siendo la nomenclatura tradicional la más extensa.

Ecuaciones Químicas
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos ó reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas.
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción
La ecuación química nos ayuda a visualizar los reactivos que son los que tendrán una reacción química y el producto que es lo que se obtiene de este proceso. Además podemos ubicar los símbolos químicos de cada uno de los elementos que estén dentro de la ecuación y poder balancearlos con mayor facilidad y gran rapidez.

Recapitulación Viernes 22/Octubre
Recapitulación
Equipo 1
El día martes 19 de octubre realizamos una práctica donde observamos la reacción química del oxigeno con metales y llegamos a la conclusión de que está mezcla produce hidróxidos.
El día jueves 21 de octubre ralizamos una práctica similar a la del martes pero ahora con no-metales y observamos que produce anhidridos y estos a su vez mezclados con agua producen oxiácidos.
Equipo 1
El día martes 19 de octubre realizamos una práctica donde observamos la reacción química del oxigeno con metales y llegamos a la conclusión de que está mezcla produce hidróxidos.
El día jueves 21 de octubre ralizamos una práctica similar a la del martes pero ahora con no-metales y observamos que produce anhidridos y estos a su vez mezclados con agua producen oxiácidos.
domingo, 24 de octubre de 2010
Reacción Química del Oxigeno con No-Metales
¿Cuales son los productos que se obtienen de la Reacción Química del Oxigeno con No-Metales?
Ecuación General
No-metal + Oxigeno = Anhídrido u Oxido No-Metálico
NoMe + O = No MeO
Los anhídridos con el agua producen oxiácidos.
NoMeO + Agua = Oxiácidos
NoMeO +H2O = HNoMeO
Reacciones de los No Metales con el Oxigeno y el Agua.
Material: Cucharilla de combustión, lámpara de alcohol, vaso de precipitados 100 ml, agitador de vidrio.
Sustancias: Azufre, Carbono, Yodo, Cloro
Procedimiento:
- Colocar una muestra de la sustancia en la cucharilla de combustión.
- Colocar 50 ml de agua en el vaso de precipitados y agregar cinco gotas del indicador universal.
- Calentar dos minutos las sustancias de la cucharilla de combustión e introducirla en el vaso con indicador y aguas x q explota.
- Observar y anotar los cambios.

Conclusiones:
Los no metales reaccionan con el oxigeno para producir los anhídridos y estos con el agua producen oxiácidos.
(No me pasaron las fotos de la práctica, en cuanto me las manden las subo)
Reacción Química del Oxigeno con Metales
¿Cuales son los productos de Reacción Química del Oxigeno con Metales?

Reacción Química General
Metal + Oxigeno = Oxido Metálico u Oxido Básico
Me + O = MeO
Reacción de Metales con el Oxigeno
Material: Lámpara de alcohol, cucharilla de combustión, vaso de precipitados 100 ml, agitador de vidrio.
Sustancias: Aluminio, cobre, hierro, magnesio, zinc.
Procedimiento:
- Colocar cada metal en la cucharilla de combustión.
- Colocar dos minutos a la flama del mechero la cucharilla combustión.
- Colocar 25 mililitros de agua en el vaso de precipitados y agregarle cinco gotas del indicador universal.
- Introducir la cucharilla de combustión en el vaso con agua.
- Observar y anotar los resultados.

Conclusiones: Los metales con el oxigeno producen óxidos básicos y estos con el agua producen hidróxidos.
(No me pasaron las fotos de la práctica, en cuanto me las manden las subo ^^)

Reacción Química General
Metal + Oxigeno = Oxido Metálico u Oxido Básico
Me + O = MeO
Reacción de Metales con el Oxigeno
Material: Lámpara de alcohol, cucharilla de combustión, vaso de precipitados 100 ml, agitador de vidrio.
Sustancias: Aluminio, cobre, hierro, magnesio, zinc.
Procedimiento:
- Colocar cada metal en la cucharilla de combustión.
- Colocar dos minutos a la flama del mechero la cucharilla combustión.
- Colocar 25 mililitros de agua en el vaso de precipitados y agregarle cinco gotas del indicador universal.
- Introducir la cucharilla de combustión en el vaso con agua.
- Observar y anotar los resultados.

Conclusiones: Los metales con el oxigeno producen óxidos básicos y estos con el agua producen hidróxidos.
(No me pasaron las fotos de la práctica, en cuanto me las manden las subo ^^)
domingo, 17 de octubre de 2010
Indagación Bibliografica 18-22 Oct
UNIDAD 2
TERCERA SEMANA
Reacción Química del Oxigeno con Metales y no-metales
Metales
La mayor parte de los elementos metálicos exhibe el lustrebrillante que asociamos a los metales. Los metales conducen el calor y laelectricidad, son maleables (se pueden golpear para formar láminas delgadas) ydúctiles (se pueden estirar para formar alambres). Todos son sólidos atemperatura ambiente con excepción del mercurio (punto de fusión =-39 ºC),que es un líquido. Dos metales se funden ligeramente arriba de la temperaturaambiente: el cesio a 28.4 ºC y el galio a 29.8 ºC. En el otro extremo, muchosmetales se funden a temperaturas muy altas. Por ejemplo, el cromo se funde a1900 ºC.
Los metales tienden a tener energías de ionización bajas ypor tanto se oxidan (pierden electrones) cuando sufren reacciones químicas. Losmetales comunes tienen una relativa facilidad de oxidación. Muchos metales seoxidan con diversas sustancias comunes, incluidos 02 Y los ácidos.
Se utilizan con fines estructurales, fabricación derecipientes, conducción del calor y la electricidad. Muchos de los iones metálicoscumplen funciones biológicas importantes: hierro, calcio, magnesio, sodio,potasio, cobre, manganeso, cinc, cobalto, molibdeno, cromo, estaño, vanadio, níquel,....
NO METALES
Los no metales varían mucho ensu apariencia no son lustrosos y por lo general son malos conductores del calory la electricidad. Sus puntos de fusión son más bajos que los de los metales(aunque el diamante, una forma de carbono, se funde a 3570 ºC). Varios nometales existen en condiciones ordinarias como moléculas diatómicas. En estalista están incluidos cinco gases (H2, N2, 02,F2 y C12), un líquido (Br2) y un sólido volátil(I2). El resto de los no metales son sólidos que pueden ser duroscomo el diamante o blandos como el azufre. Al contrario de los metales,son muy frágiles y no pueden estirarse en hilos ni en láminas. Se encuentranen los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno),líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y noreflejan la luz. Muchos no metales se encuentran en todos los seres vivos:carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidadesimportantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro.
Oxigeno
El oxígeno es el elemento más abundante de la corteza:50,3% en peso (incluyendo agua y atmósfera). El O2 es la forma alotrópicamás abundante del oxígeno. El oxígeno es incoloro, inodoro e insípido. Enestado líquido y sólido es azul pálido y fuertemente paramagnético. Lasolubilidad en agua disminuye con el aumento de la temperatura.
El ozono (O3) (la otra forma alotrópica del oxígeno).Es un gas diamagnético azulado, de olor característico (el que se percibedespués de las tormentas con importante aparato eléctrico). Es débilmentesoluble en agua. En estado líquido es azul oscuro y en estado sólido esvioleta oscuro.

TERCERA SEMANA
Reacción Química del Oxigeno con Metales y no-metales
Metales
La mayor parte de los elementos metálicos exhibe el lustrebrillante que asociamos a los metales. Los metales conducen el calor y laelectricidad, son maleables (se pueden golpear para formar láminas delgadas) ydúctiles (se pueden estirar para formar alambres). Todos son sólidos atemperatura ambiente con excepción del mercurio (punto de fusión =-39 ºC),que es un líquido. Dos metales se funden ligeramente arriba de la temperaturaambiente: el cesio a 28.4 ºC y el galio a 29.8 ºC. En el otro extremo, muchosmetales se funden a temperaturas muy altas. Por ejemplo, el cromo se funde a1900 ºC.
Los metales tienden a tener energías de ionización bajas ypor tanto se oxidan (pierden electrones) cuando sufren reacciones químicas. Losmetales comunes tienen una relativa facilidad de oxidación. Muchos metales seoxidan con diversas sustancias comunes, incluidos 02 Y los ácidos.
Se utilizan con fines estructurales, fabricación derecipientes, conducción del calor y la electricidad. Muchos de los iones metálicoscumplen funciones biológicas importantes: hierro, calcio, magnesio, sodio,potasio, cobre, manganeso, cinc, cobalto, molibdeno, cromo, estaño, vanadio, níquel,....
NO METALES
Los no metales varían mucho ensu apariencia no son lustrosos y por lo general son malos conductores del calory la electricidad. Sus puntos de fusión son más bajos que los de los metales(aunque el diamante, una forma de carbono, se funde a 3570 ºC). Varios nometales existen en condiciones ordinarias como moléculas diatómicas. En estalista están incluidos cinco gases (H2, N2, 02,F2 y C12), un líquido (Br2) y un sólido volátil(I2). El resto de los no metales son sólidos que pueden ser duroscomo el diamante o blandos como el azufre. Al contrario de los metales,son muy frágiles y no pueden estirarse en hilos ni en láminas. Se encuentranen los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno),líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y noreflejan la luz. Muchos no metales se encuentran en todos los seres vivos:carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidadesimportantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro.
Oxigeno
El oxígeno es el elemento más abundante de la corteza:50,3% en peso (incluyendo agua y atmósfera). El O2 es la forma alotrópicamás abundante del oxígeno. El oxígeno es incoloro, inodoro e insípido. Enestado líquido y sólido es azul pálido y fuertemente paramagnético. Lasolubilidad en agua disminuye con el aumento de la temperatura.
El ozono (O3) (la otra forma alotrópica del oxígeno).Es un gas diamagnético azulado, de olor característico (el que se percibedespués de las tormentas con importante aparato eléctrico). Es débilmentesoluble en agua. En estado líquido es azul oscuro y en estado sólido esvioleta oscuro.

Hidrocarburos y Gases de Combustión

Hidrocarburos y gases de combustión:
Ejemplo: Metano CH4 + 4 O ---- CO2 Dióxido de carbono + 2 H2O CO monóxido de carbono y
Por equipo completar y balancear las ecuaciones siguientes:
1.- Etano C2H6 + 7O ----------------- 2CO2 + 3H2O
2.- Propano C3H8 + 10 O ------------ 3CO 2 + 4H2O
3.- Butano C4H10...+13 O----4CO2+5H2O
4.- Pentano C5H12--------C5H12 +16O5CO2+6H2O
5.- Hexano C6H14 ------------------C6 H14 +19 O ------ =6 CO2 + H2O 6.- Heptano C7H18---23O--7CO2 +9H2O
Indagación Bibliografica 11-15 Oct
UNIDAD 2
SEGUNDA SEMANA
Lluvia Ácida
La lluvia ácida se forma cuando la humedad en el aire se combina con los óxidos de nitrógeno y el dióxido de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados del petróleo. En interacción con el vapor de agua, estos gases forman ácido sulfúrico y ácidos nítricos. Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.
Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes distancias, siendo trasladados por los vientos cientos o miles de kilómetros antes de precipitar en forma de rocío, lluvia, llovizna, granizo, nieve, niebla o neblina. Cuando la precipitación se produce, puede provocar importantes deterioros en el ambiente.
La lluvia normalmente presenta un pH de aproximadamente 5.65 (ligeramente ácido), debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH de menos de 5 y puede alcanzar el pH del vinagre (pH 3). Estos valores de pH se alcanzan por la presencia de ácidos como el ácido sulfúrico, H2SO4, y el ácido nítrico, HNO3. Estos ácidos se forman a partir del dióxido de azufre, SO2, y el monóxido de nitrógeno que se convierten en ácidos.
Los hidrocarburos y el carbón usados como fuente de energía, en grandes cantidades, pueden también producir óxidos de azufre y nitrógeno y el dióxido de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados del petróleo.

Efectos de la lluvia ácida en un bosque de la República Checa
Contaminantes en la Cd. de México
Preocupantes niveles de contaminación han sido registrados en Ciudad de México. Pese a que ya sabíamos que era una de las ciudades más contaminadas del planeta, nos han sorprendido los datos que se desprenden del Primer Informe de Registro de Emisiones y Transferecia de Contaminantes (RETC) del Distrito Federal.
Allí podemos observar como cada año se vierten 2.814 kilogramos de plomo en aguas residuales. Además, otros contaminantes que van a parar al sistema de alcantarillado y drenaje de la ciudad son el cadmio, el níquel, y el etanol.
Por sectores, el de servicios se lleva la palma con 1.314 kilogramos anuales de plomo, seguido del sector industrial con 1.145 kilogramos y del comercio con 355 kilogramos.
Por si eso fuera poco, el aire está muy contaminado. Nada más y nada menos que 547.000 toneladas de dióxido de carbono se expanden cada año por Ciudad de México. Las industrias que más tienen que ver con esas emisiones son la tabacalera, la de bebidas y la alimentaria por el uso que ello comporta en combustibles para los transportes.
Para finalizar, en el informe se ha comentado que también se lanzan sustancias potencialmente cancerígenas para el hombre como el estireno o vinilbenceno, con más de 10.000 toneladas que provienen de la industria del plástico y hule.

Vehículos que circulan en la Cd. de México
Mucha es la gente que considera que deberíamos empezar a tratar en serio el grave problema del medio ambiente en México, y es que cada vez son más las voces que gritan por un país más puro de emisiones y ruidos. Así pues, colectivos como Mexicohazalgo o Greenpeace denuncian que México D.F. es una de las ciudades más contaminadas y contaminantes del mundo, y considero que ya es hora de que empecemos a tomarnos el asunto en serio.
Con una población cercana a los nueve millones de habitantes, muchos denuncian como uno de los principales culpables de tanta contaminación a la gran cantidad de vehículos en Ciudad de México. Así pues, muchos son los que defienden el uso de coches ecológicos, debido a que el uso de energías renovables y más limpias, ayuda al control y la disminución de gases CO2, que tanto perjudican a nuestro planeta tierra.
Muchas personas, consideran que carros ecológicos, que funcionan mediante energía solar, o mediante la propia electricidad, no alcanzan velocidades elevadas, con baterías que deben recargarse cada poco tiempo y, que además son muy caros. Pues desde aquí queremos informar a la gente que dichos argumentos no solamente son erróneos, sino que además al final acabamos ahorrando porque no tenemos que ponerle gasolina a nuestros carros, y en caso que todos estos argumentos no les parezcan suficientes, simplemente piensen en que utilizando los coches ecológicos, podemos dejar a nuestros hijos y nietos, un México más limpio.
La Verificación de los Vehículos
I.1 Los vehículos nuevos o usados que se registren por primera vez en el Distrito Federal deberán ser verificados dentro de los 180 días naturales contados a partir de la fecha de la tarjeta de circulación; la constancia de verificación respectiva corresponderá al semestre en que ésta se realice.
I.2 Las unidades nuevas o usadas con registro por primera vez en el Distrito Federal se sujetarán a las restricciones a la circulación establecidas en el Programa "Hoy No Circula" y el Programa de “Contingencias Ambientales”, de acuerdo a lo siguiente:
a) Si carece de holograma de verificación de emisiones doble cero “00” ó cero “0”, deberá dejar de circular de acuerdo a lo establecido en el Programa "Hoy No Circula" y el Programa de “Contingencias Ambientales”, hasta en tanto les sea asignado el holograma que corresponda mediante la verificación respectiva.
b) Si el vehículo presenta un holograma doble cero “00” ó cero “0” vigente, otorgado o reconocido por el Gobierno del Distrito
Federal, estará exento de las restricciones a los Programas "Hoy No Circula" y de “Contingencias Ambientales”.
Programa Hoy no Circula
El Programa Hoy No Circula es el nombre de un programa de reducción de contaminación aplicado en el Distrito Federal (México) para mejorar la calidad de aire. Un sistema similar opera en el vecino estado de México.
El Hoy no Circula comenzó en la última parte del año 1989 y consiste en la restricción de la circulación a la quinta parte vehicular por un día entre lunes y viernes, dependiendo del último número de la placa vehicular expedida por el gobierno capitalino (véase la tabla a la derecha). El programa fue planificado para aplicarse sólo en el invierno, después de la temporada de lluvia en el Distrito Federal y cuando las inversiones térmicas incrementaban la concentración de contaminantes en la atmósfera del Valle de México. Sin embargo, después del invierno de 1990, el programa se estableció de manera permanente.
El Hoy no Circula fue acompañado por un amplio monitoreo de la emisión de gases contaminantes de los automotores registrados en el Distrito Federal, revista que deben pasar cada seis meses para que se determine si pueden circular en la capital o deben ser ajustados. Este procedimiento es llamado verificación vehicular.
En 1997, para estimular el empleo de nuevos vehículos automotores con un consumo de combustible más eficiente, equipados con convertidor catalítico, los automóviles fabricados después de 1993 se convirtieron en candidatos a exentar la restricción a la circulación, siempre y cuando fueran presentados por sus dueños a la verificación y que los resultados de ésta fueran satisfactorios. Como resultado de ello, en 2003 sólo se restringió la circulación al 7.6% de los vehículos capitalinos cada día de la semana, bajando desde el 20% propuesto originalmente. También quedan exceptuados del programa los vehículos que consumen gas licuado de petróleo y aquéllos destinados para emergencias. Al haber cumplido 8 años en servicio, cualquier vehículo del Distrito Federal debe observar las restricciones del Hoy no circula. Para saber si un vehículo está exento o no del programa, son adheridas en los cristales del mismo una calcomanía que los distingue.
Contaminación Ambiental por la Planta Industrial
La generación de contaminantes emitidos a la atmósfera por el sector industrial es variada, dependiendo de la rama industrial y de la composición del sector en cada región del país.
Las zonas con mayor volumen de emisiones a la atmósfera son, en general, corredores industriales y zonas metropolitanas donde además hay una fuerte presencia de refinerías y/o plantas termoeléctricas. Se aprecia además una clara correlación entre la emisión de SO2 y PST y el volumen total de contaminantes emitidos en ellas, debido a la naturaleza del combustóleo empleado, que suele tener un alto contenido de azufre. Esta tendencia debe revertirse en parte con la introducción de un nuevo combustóleo más liviano.
El contaminante más representativo de las emisiones de la industria es el bióxido de azufre, que representa un 60% del total, seguido de los óxidos de nitrógeno con un 16%, el monóxido de carbono con 10%, los hidrocarburos con un 7% y las partículas suspendidas totales con 7%, como se observa en la gráfica siguiente
En este trabajo trataremos el caso particular de la producción de ácido súlfurico para conocer los contaminantes que se generan en estas industrias y las mediddas de seguridad que se deben tener en su fabricación y manejo; así como el control de emisión de contaminantes por estas industrias.
Para el desarrollo de este trabajo partiremos de las características generales del ácido sulfúrico, su proceso de fabricación donde podemos ver cuales son los principales contaminantes que se generan en este, y después ver como podemos controlar las emisiones de estos contaminantes.
Dadas las características y propiedades del ácido sulfúrico, su toxicidad, reactividad, corrosion, es de gran importancia hablar sobre las medidas de seguridad y precauciones que se deben de tener en su manejo y fabricación; ya que una emision medible provocada por la industria puede ser controlada mediante ciertos equipos, pero en estos casos hay que poner gran atención en los posibles incidentes y accidentes, ya que estos podrían causar un gran impacto ambiental y grandes riesgos a la salud, por lo que hay que tener siempre bien establecidas, las medidas de seguridad y precauciones en esta industria.
Normas ambientales en México
Su antecedente más cercano es la Ley Federal para Prevenir y Controlar la Contaminación de 1971
La Ley Federal de Protección al Ambiente de 1982;
En el año de 1988 durante el mandato del Licenciado Miguel De la Madrid Hurtado, se decreta la primera ley marco con pretensiones de ordenar el ambiente
En el año 1996 sufre una trascendental reforma.
La LGEEPA sufrió una modificación trascendental en el año de 1996, publicada el 13 de diciembre. En virtud de ello es necesario analizar la exposición de motivos con la finalidad de conocer cuales son los objetivos y metas que se pretender alcanzar con estas reformas.
Las reformas, adiciones y derogaciones que se hicieron fueron productode las consideraciones, recomendaciones e inquietudes que fueron propuestas por los diversos sectores de la sociedaddurante la Consulta Nacional sobre Legislación Ambiental, convocada en el año de 1995 por la comisión de ecología y medio ambientede las cámaras de diputados y senadores.
A dicha convocatoria respondieron organizaciones son gubernamentales, centro de investigación, universidades, agrupaciones de productores, cámaras empresariales, dependencias y entidades de la administración pública federal, estatal y municipal, organismos cívicos internaciones, entre otros.
Entre los motivos que impulsaron esta reforma fue el anhelo de los mexicanos a vivir en un ambiente sano y adecuado para la vida y el desarrollo de nuevas generaciones, así como promover el desarrollo sustentable de los recursos naturales y la viabilidad de las normas propuestas en atencióna los factores económicos, sociales y culturales que inciden en la eficacia de las mismas.
En términos generales esta modificación tuvo como propósito:
•Establecer un proceso de descentralizaciónordenado, efectivo y gradual de la administración, ejecución y gradual de la administración, ejecución y vigilancia ambiental a favor de las autoridades locales.
•Ampliar los márgenes de participación ciudadana en la gestiónambiental, a través de mecanismos como la denuncia popular, el acceso a la información ambiental y la posibilidad de impugnar por medio jurídicos los actos que dañen el ambiente en contravención de la normatividad vigente.
•Reducir los márgenes de discrecionalidad de la autoridad, a fin de ampliar la seguridad jurídica de la ciudadanía en materia ambiental.
•Incorporar instrumentos económicos de gestión ambiental, al igual que figuras jurídicas de cumplimiento voluntario de la ley, como las auditorias ambientales.
•Fortalecer y enriquecer los instrumentos de la política ambiental para que se cumplan eficazmente con su finalidad.
•Incorporar definiciones de conceptos hoy considerados fundamentales como los de sustentabilidad y biodiversidad, a fin de aplicarlos en las distintas acciones reguladas por el propio ordenamiento.
•Asegurar la congruencia de la LGEEPA con las leyes sobre normalización, procedimientos administrativos y organización de la administración pública federal.

sábado, 9 de octubre de 2010
ATMOSFERA Oxidación de combustibles
ATMOSFERA Oxidación de combustibles
¿Cuál combustible es más contaminante del aire?
Material: Caldero, probeta graduada 10 ml. cronómetro.
Sustancias: Alcohol, Gasolina, Aceite, Petróleo Diáfano.
Procedimiento:
- Medir cinco ml de Cada sustancia una por una
- Colocarla dentro del caldero.
- Encender el combustible y medir el tiempo de consumo de los cinco ml.
- Observar cual de los combustibles desprende más contaminantes.
- Observaciones:

Conclusiones:
En el ambiente existen distintos tipos de contaminantes, algunos tienen un grado muy bajo de contaminación pero algunos otros son muy dañinos. Al realizar el experimento llegamos a la conclusión de que el combustible más contaminante del aire es el Petróleo Diáfano.
Al observar la cantidad de humo negro que se desprende al quemar este combustible, seria bueno hacer conciencia sobre toda la contaminación que hay en la atmósfera y tratar de contribuir a no contaminar tanto el ambiente.
¿Cuál combustible es más contaminante del aire?
Material: Caldero, probeta graduada 10 ml. cronómetro.
Sustancias: Alcohol, Gasolina, Aceite, Petróleo Diáfano.
Procedimiento:
- Medir cinco ml de Cada sustancia una por una
- Colocarla dentro del caldero.
- Encender el combustible y medir el tiempo de consumo de los cinco ml.
- Observar cual de los combustibles desprende más contaminantes.
- Observaciones:

Conclusiones:
En el ambiente existen distintos tipos de contaminantes, algunos tienen un grado muy bajo de contaminación pero algunos otros son muy dañinos. Al realizar el experimento llegamos a la conclusión de que el combustible más contaminante del aire es el Petróleo Diáfano.
Al observar la cantidad de humo negro que se desprende al quemar este combustible, seria bueno hacer conciencia sobre toda la contaminación que hay en la atmósfera y tratar de contribuir a no contaminar tanto el ambiente.
lunes, 4 de octubre de 2010
Indagación Bibliografica 4-8 Oct
UNIDAD 2
PRIMERA SEMANA
¿Qué les sucede a las sustancias al Quemarlas?
Combustión
La combustión es una reacción química en la cual generalmente se desprende una gran cantidad de calor y luz.
En toda combustión existe un elemento que arde y se denomina (combustible) y otro que produce la combustión (comburente), generalmente oxígeno en forma de O2 gaseoso. Los explosivos tienen oxígeno ligado químicamente por lo que no necesitan el oxígeno del aire para realizar la combustión.
Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno. En una reacción completa todos los elementos tienen el mayor estado de oxidación. Los productos que se forman son el dióxido de carbono (CO2) y el agua, el dióxido de azufre (SO2) (si el combustible contiene azufre) y pueden aparecer óxidos de nitrógeno (NOx), dependiendo de la temperatura de reacción.
En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas.
El proceso de destruir materiales por combustión se conoce como incineración.
Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define como, en °C y a 1 atm, temperatura a la que los vapores de un combustible arden espontáneamente.
La temperatura de inflamación, en °C y a 1 atm es aquella que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión.

Oxidación de Combustibles
La oxidación es una reacción química donde un metal o un no metal cede electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
Tipos de oxidación
•Oxidación lenta
◦La que ocurre casi siempre en los metales a causa del agua o aire, causando su corrosión y pérdida de brillo y otras propiedades características de los metales, desprendiendo cantidades de calor inapreciables; al fundir un metal se acelera la oxidación, pero el calor proviene principalmente de la fuente que derritió el metal y no del proceso químico (una excepción sería el aluminio en la soldadura autógena).
•Oxidación rápida
◦La que ocurre durante lo que ya sería la combustión, desprendiendo cantidades apreciables de calor, en forma de fuego, y ocurre principalmente en substancias que contienen carbono e hidrógeno, (Hidrocarburos)
Consecuencias
En los metales una consecuencia muy importante de la oxidación es la corrosión, fenómeno de impacto económico muy negativo.
Combinando las reacciones de oxidación-reducción (redox) en una celda galvánica se consiguen las pilas electroquímicas(ver pila eléctrica). Estas reacciones pueden aprovecharse para evitar fenómenos de corrosión no deseados mediante la técnica del ánodo de sacrificio y para la obtención de corriente eléctrica continua.
¿Se Puede detener la Contaminación del Aire en la Ciudad de México?
Efecto Invernadero
Se denomina efecto invernadero al fenómeno por el cual determinados gases, que son componentes de una atmósfera planetaria, retienen parte de la energía que el suelo emite por haber sido calentado por la radiación solar. Afecta a todos los cuerpos planetarios dotados de atmósfera. De acuerdo con la mayoría de la comunidad científica, el efecto invernadero se está viendo acentuado en la Tierra por la emisión de ciertos gases, como el dióxido de carbono y el metano, debida a la actividad humana.
Este fenómeno evita que la energía solar recibida constantemente por la Tierra vuelva inmediatamente al espacio, produciendo a escala planetaria un efecto similar al observado en un invernadero.
_2008_svg.png)
Emisión de CO2 por País

En el siguiente link se pueden encontrar las estadisticas de emisión de CO2 por cada país:
http://es.wikipedia.org/wiki/Anexo:Pa%C3%ADses_por_emisiones_de_di%C3%B3xido_de_carbono
El ozono
El ozono (O3), es una sustancia cuya molécula está compuestas por tres átomos de oxígeno, formada al disociarse los 2 átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno (O2), formando moléculas de Ozono (O3).
A temperatura y presión ambientales el ozono es un gas de olor acre y generalmente incoloro, pero en grandes concentraciones puede volverse ligeramente azulado. Si se respira en grandes cantidades, es tóxico y puede provocar la muerte.
El ozono, es el primer alótropo de un elemento químico que fue identificado por la ciencia, Christian Friedrich Schönbein propuso que fuera un compuesto químico distinto en 1840, nombrándolo con el verbo griego ozein (ὄζειν, "tener olor"), a causa del olor peculiar que se observa durante las tormentas eléctricas. Recién en 1865 Jacques-Louis Soret determinó la fórmula del ozono (O3) lo que fue confirmado por Schönbein en 1867.
Se descompone rápidamente en presencia de oxígeno a temperaturas mayores de 100 °C y en presencia de catalizadores como el dióxido de manganeso (MnO2) a temperatura ambiente.
Ozono Troposférico
También denominado ozono ambiental. Se trata de un gas incoloro que se crea a través de reacciones fotoquímicas entre óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV) derivados de fuentes como la quema de combustible. Es el compuesto más destacado de los oxidantes fotoquímicos y forma parte del smog.
Puede encontrarse en la zona más baja de la atmósfera, ya que proviene de emisiones naturales de COV, NOx y CO, así como del ozono estratosférico descendente. Esto se convierte en un problema, puesto que el ozono, en concentración suficiente puede provocar daños en la salud humana (a partir de unos 150 microgramos por metro cúbico) o en la vegetación (a partir de unos 30 ppb (partes por billón americano)) y contribuye a generar un calentamiento en la superficie de la tierra. Estas características del ozono han propiciado que dentro de la Unión Europea aparezca una normativa relativa al ozono en el aire ambiente, que establece el nuevo régimen jurídico comunitario sobre el ozono troposférico presente en la baja atmósfera.
Su formación empieza a partir de la emisión del dióxido de nitrógeno (NO2) e hidrocarburos (compuestos que reaccionan en la presencia de calor y luz solar para producir ozono).
El mecanismo mediante el cual se genera el ozono en la troposfera es completamente distinto, ya que a esta altura no llegan las radiaciones ultravioletas. El ozono en este caso, se forma a partir de ciertos precursores (NOx - óxidos de nitrógeno; y VOCs - compuestos orgánicos volátiles, como el formaldehído), contaminantes provenientes de la actividad humana. Estos contaminantes se disocian formando radicales con radiación menos energética, y dichos radicales pueden formar ozono con el oxígeno molecular.
El conjunto del ozono, NOx y VOCs forma una neblina visible en zonas muy contaminadas denominada smog fotoquímicoo smog de invierno.
PRIMERA SEMANA
¿Qué les sucede a las sustancias al Quemarlas?
Combustión
La combustión es una reacción química en la cual generalmente se desprende una gran cantidad de calor y luz.
En toda combustión existe un elemento que arde y se denomina (combustible) y otro que produce la combustión (comburente), generalmente oxígeno en forma de O2 gaseoso. Los explosivos tienen oxígeno ligado químicamente por lo que no necesitan el oxígeno del aire para realizar la combustión.
Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno. En una reacción completa todos los elementos tienen el mayor estado de oxidación. Los productos que se forman son el dióxido de carbono (CO2) y el agua, el dióxido de azufre (SO2) (si el combustible contiene azufre) y pueden aparecer óxidos de nitrógeno (NOx), dependiendo de la temperatura de reacción.
En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas.
El proceso de destruir materiales por combustión se conoce como incineración.
Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define como, en °C y a 1 atm, temperatura a la que los vapores de un combustible arden espontáneamente.
La temperatura de inflamación, en °C y a 1 atm es aquella que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión.

Oxidación de Combustibles
La oxidación es una reacción química donde un metal o un no metal cede electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
Tipos de oxidación
•Oxidación lenta
◦La que ocurre casi siempre en los metales a causa del agua o aire, causando su corrosión y pérdida de brillo y otras propiedades características de los metales, desprendiendo cantidades de calor inapreciables; al fundir un metal se acelera la oxidación, pero el calor proviene principalmente de la fuente que derritió el metal y no del proceso químico (una excepción sería el aluminio en la soldadura autógena).
•Oxidación rápida
◦La que ocurre durante lo que ya sería la combustión, desprendiendo cantidades apreciables de calor, en forma de fuego, y ocurre principalmente en substancias que contienen carbono e hidrógeno, (Hidrocarburos)
Consecuencias
En los metales una consecuencia muy importante de la oxidación es la corrosión, fenómeno de impacto económico muy negativo.
Combinando las reacciones de oxidación-reducción (redox) en una celda galvánica se consiguen las pilas electroquímicas(ver pila eléctrica). Estas reacciones pueden aprovecharse para evitar fenómenos de corrosión no deseados mediante la técnica del ánodo de sacrificio y para la obtención de corriente eléctrica continua.
¿Se Puede detener la Contaminación del Aire en la Ciudad de México?
Efecto Invernadero
Se denomina efecto invernadero al fenómeno por el cual determinados gases, que son componentes de una atmósfera planetaria, retienen parte de la energía que el suelo emite por haber sido calentado por la radiación solar. Afecta a todos los cuerpos planetarios dotados de atmósfera. De acuerdo con la mayoría de la comunidad científica, el efecto invernadero se está viendo acentuado en la Tierra por la emisión de ciertos gases, como el dióxido de carbono y el metano, debida a la actividad humana.
Este fenómeno evita que la energía solar recibida constantemente por la Tierra vuelva inmediatamente al espacio, produciendo a escala planetaria un efecto similar al observado en un invernadero.
_2008_svg.png)
Emisión de CO2 por País

En el siguiente link se pueden encontrar las estadisticas de emisión de CO2 por cada país:
http://es.wikipedia.org/wiki/Anexo:Pa%C3%ADses_por_emisiones_de_di%C3%B3xido_de_carbono
El ozono
El ozono (O3), es una sustancia cuya molécula está compuestas por tres átomos de oxígeno, formada al disociarse los 2 átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno (O2), formando moléculas de Ozono (O3).
A temperatura y presión ambientales el ozono es un gas de olor acre y generalmente incoloro, pero en grandes concentraciones puede volverse ligeramente azulado. Si se respira en grandes cantidades, es tóxico y puede provocar la muerte.
El ozono, es el primer alótropo de un elemento químico que fue identificado por la ciencia, Christian Friedrich Schönbein propuso que fuera un compuesto químico distinto en 1840, nombrándolo con el verbo griego ozein (ὄζειν, "tener olor"), a causa del olor peculiar que se observa durante las tormentas eléctricas. Recién en 1865 Jacques-Louis Soret determinó la fórmula del ozono (O3) lo que fue confirmado por Schönbein en 1867.
Se descompone rápidamente en presencia de oxígeno a temperaturas mayores de 100 °C y en presencia de catalizadores como el dióxido de manganeso (MnO2) a temperatura ambiente.
Ozono Troposférico
También denominado ozono ambiental. Se trata de un gas incoloro que se crea a través de reacciones fotoquímicas entre óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV) derivados de fuentes como la quema de combustible. Es el compuesto más destacado de los oxidantes fotoquímicos y forma parte del smog.
Puede encontrarse en la zona más baja de la atmósfera, ya que proviene de emisiones naturales de COV, NOx y CO, así como del ozono estratosférico descendente. Esto se convierte en un problema, puesto que el ozono, en concentración suficiente puede provocar daños en la salud humana (a partir de unos 150 microgramos por metro cúbico) o en la vegetación (a partir de unos 30 ppb (partes por billón americano)) y contribuye a generar un calentamiento en la superficie de la tierra. Estas características del ozono han propiciado que dentro de la Unión Europea aparezca una normativa relativa al ozono en el aire ambiente, que establece el nuevo régimen jurídico comunitario sobre el ozono troposférico presente en la baja atmósfera.
Su formación empieza a partir de la emisión del dióxido de nitrógeno (NO2) e hidrocarburos (compuestos que reaccionan en la presencia de calor y luz solar para producir ozono).
El mecanismo mediante el cual se genera el ozono en la troposfera es completamente distinto, ya que a esta altura no llegan las radiaciones ultravioletas. El ozono en este caso, se forma a partir de ciertos precursores (NOx - óxidos de nitrógeno; y VOCs - compuestos orgánicos volátiles, como el formaldehído), contaminantes provenientes de la actividad humana. Estos contaminantes se disocian formando radicales con radiación menos energética, y dichos radicales pueden formar ozono con el oxígeno molecular.
El conjunto del ozono, NOx y VOCs forma una neblina visible en zonas muy contaminadas denominada smog fotoquímicoo smog de invierno.
Suscribirse a:
Entradas (Atom)